
| A、AgCl和Ag2CrO4的溶解度相等 |
| B、AgCl的溶解度大于Ag2CrO4的溶解度 |
| C、两者类型不同,不能由Ksp的大小直接判断溶解能力的大小 |
| D、都是难溶盐,溶解度无意义 |


科目:高中化学 来源: 题型:
| A、K+一定存在 |
| B、每份取样溶液中含0.02mol CO32- |
| C、Cl-可能存在 |
| D、Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8×10-6 mol?L-1 |
| B、4.2×10-6mol?L-1 |
| C、2.8×10-4 mol?L-1 |
| D、8.4×10-4 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
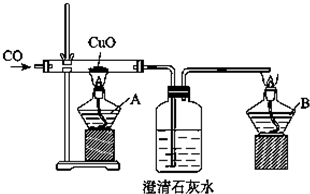
查看答案和解析>>
科目:高中化学 来源: 题型:
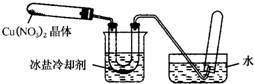 某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.
某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色, |
| 步骤2:取少量溶液,滴加酸性KMnO4溶液 | |
| 步骤3: | 若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuS 不溶于强酸,FeS 可溶于强酸 |
| B、CuS 比FeS的溶解度更小 |
| C、H2S液中电离出的S2-浓度相当大 |
| D、转化成CuS是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| (三) | (一) | (五) | (二) | (六) | (四) |
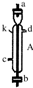 |  | 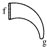 |  | 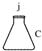 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、② |
| C、①③④⑤ | D、①②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com