
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:

在阳极区发生的反应包括 和H ++ HCO3-=H2O+CO2↑。
简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g)+1/2 O2(g)=H2O(g) Δ H1= -242 kJ/mol
CH3OH(g)+3/2 O2(g)=CO2 (g)+2 H2O(g) Δ H2= -676 kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式 。
下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。
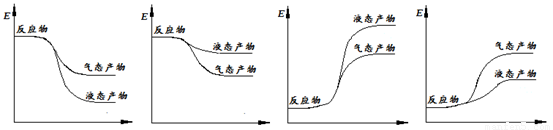
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇
微生物燃料电池中,电解质溶液为酸性,示意图如下:

该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
A电极附近甲醇发生的电极反应式为 。
(1)①4OH--4e-=2H2O+O2↑(2分)
②答案1:HCO3 –存在电离平衡:HCO3 – H++CO32- (1分),阴极H+放电浓度减小平衡右移(1分)CO32-再生
H++CO32- (1分),阴极H+放电浓度减小平衡右移(1分)CO32-再生
答案2:阴极H+放电OH-浓度增大(1分),OH-与HCO3 –反应生成CO32- (1分)CO32-再生
(2)①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-50 kJ/mol(2分) ② a(2分)
(3)①从A到B(1分) ②不变(1分)
③CH3OH+H2O - 6e-=6H++ CO2↑(2分)
【解析】
试题分析:(1)①阳极上H2O电离出的OH‾失电子,电极方程式为:4OH - - 4e-=2H2O+O2↑
②阴极上H+放电发生得电子反应:2H++2e‾=H2↑,HCO3‾存在电离平衡:HCO3‾ CO32‾+H+,H+浓度减小,使HCO3‾电离平衡向右移动,CO32‾浓度增大而再生。
CO32‾+H+,H+浓度减小,使HCO3‾电离平衡向右移动,CO32‾浓度增大而再生。
(2)①首先写出CO2与H2反应生成甲醇的化学方程式,并注明状态,然后根据盖斯定律求∆H=3∆H1—∆H2= -50 kJ•mol‾1,所以热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-50 kJ•mol‾1。
②该反应为放热反应,生成物为液态,放出的热量更多,所以a项图像正确。
(3) ①甲醇失去电子,为电池的负极,所以该电池外电路电子的流动方向为从A到B。
②B电极上O2得电子消耗H+,同时溶液中的H+移向B电极室,所以B电极室溶液的pH与工作前相比将不变。
③CH3OH失电子,生成CO2和H+,根据化合价变化和元素守恒配平方程式:CH3OH+H2O - 6e-=6H++ CO2↑
考点:本题考查电解原理、原电池原理、方程式的书写、平衡移动、热化学方程式的书写。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
| A、1200亿吨 | B、120亿吨 | C、200亿吨 | D、400亿吨 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
(1)写出两个典型的人类活动产生的CO2的化学方程式。
(2)若把这200亿吨CO2完全转化为淀粉,每年可生成淀粉多少亿吨?若将这些淀粉完全水解,生成的葡萄糖可供人体在进行有氧呼吸时所消耗的氧气是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:022
人类在地球上活动(主要是煤和石油的利用)致使一年内产生的CO2达到200亿吨。试问:
(1)写出两个典型的人类活动产生的CO2的化学方程式。
(2)若把这200亿吨CO2完全转化为淀粉,每年可生成淀粉多少亿吨?若将这些淀粉完全水解,生成的葡萄糖可供人体在进行有氧呼吸时所消耗的氧气是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
太阳是银河系中极为普通的一颗恒星,剧烈的热核反应使之不断地向外辐射能量。太阳辐射的能量绝大部分集中在紫外波段,可见光波段和红外光波段,它们的能量分别占总辐射量的9%、44%和47%。地球的大气层中,基本不变的成分为氧、氮、氩等,占大气总量的99.96%,可变气体成分主要有CO2、水汽和臭氧等,这些气体的含量极小,但对大气物理状况的影响极大。大气臭氧层一般是指高度在离地面10~15Km的大气层,其中臭氧的浓度很低,将它折合成标准状况,其总累积厚度也不过0.3cm,其含量虽小,但对地球的气候和生物影响很大。
(1)大气压强P随距地面高度Z(m)的增大而减小,经验公式为PZ=![]() ,其中P0为地表的气压值,e=2.718。若臭氧层集中在24km的高空处,设在该高度处的温度为—50℃。试估算臭氧层的厚度。
,其中P0为地表的气压值,e=2.718。若臭氧层集中在24km的高空处,设在该高度处的温度为—50℃。试估算臭氧层的厚度。
(2)简要说明臭氧层对地球生物圈的意义。
![]() (3)臭氧层的生消可以简化成如下的反应方程:高层大气中的一个重要的光化学反应是氧分子吸收太阳辐射中波长λ<0.24μm的光子,离解为氧原子,即O2+hν(λ<0.24μm) O+O,由此可形成一系列的反应,其中最重要的是氧原子和氧分子在第三体(M)的参与下形成臭氧,其反应方程式为 。这里的M主要是氧分子或氮分子,它们是在反应过程中同时满足能量守恒和动量守恒所必须的。臭氧在λ<0.18μm的辐射作用下,能离解成氧分子和氧原子,其反应方程式为 。
(3)臭氧层的生消可以简化成如下的反应方程:高层大气中的一个重要的光化学反应是氧分子吸收太阳辐射中波长λ<0.24μm的光子,离解为氧原子,即O2+hν(λ<0.24μm) O+O,由此可形成一系列的反应,其中最重要的是氧原子和氧分子在第三体(M)的参与下形成臭氧,其反应方程式为 。这里的M主要是氧分子或氮分子,它们是在反应过程中同时满足能量守恒和动量守恒所必须的。臭氧在λ<0.18μm的辐射作用下,能离解成氧分子和氧原子,其反应方程式为 。
(4)人类的活动所产生的一些气体,能对大气中的臭氧起到破坏作用。使其含量减少,将造成严重后果,直接威胁到人类的生活和生存。近些年来,屡有在南极或北极,甚至在西藏出现臭氧空洞的报道,引起人们极大的关注。简要说明人类活动产生的那些气体对大气臭氧层能起破坏作用。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com