
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子最外层电子数与次外层电子数之比为3∶4;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)M、N的最高价氧化物的水化物中酸性较强的是(写出化学式) 。
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程 。
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ的热量,请写出表示X2燃烧热的热化学方程式 。
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式 。
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比在纯水中小。则化合物A中的化学键类型为 ;若B为常见家用消毒剂的主要成分,则B的化学式是 。
(6)均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是 ;其中一种是强酸所成的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
(1)HClO4
(2)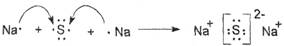
(3)2H2(g)+ O2(g) == 2H2O (l) △H=一4a kJ·mol-1
(4)H2O2 + H2S = S↓+ 2H2O
(5)离子键、(极性)共价键;NaClO
(6)HSO3- + H+ = H2O + SO2↑; Ba2+ + 2OH- +2H+ + SO42- = BaSO4↓+ 2H2O;
【解析】根据元素的结构及应该性质可知,X、Y、Z、M、N分别是H、O、、Na、S、Cl。
(1)非金属性越强,最高价氧化物的水化物的酸性越强,则M、N的最高价氧化物的水化物中酸性较强的是HClO4。
(2)Z与M可形成常见固体化合物C是硫化钠,其形成过程可表示为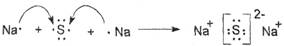 。
。
(3)1g X2在Y2中完全燃烧放出a kJ的热量,则2mol氢气完全燃烧放出的热量是4akJ,所以该反应的热化学方程式是2H2(g)+ O2(g) == 2H2O (l) △H=一4a kJ·mol-1。
(4)X与Y、X与M均可形成18电子分子,这两种分子分别是双氧水和硫化氢,二者反应的化学方程式是H2O2 + H2S = S↓+ 2H2O。
(5)根据题意可知A是氢氧化钠,含有离子键和极性键;B是次氯酸钠,化学式是NaClO。
(6)由X、Y、Z、M四种元素组成的两种盐分别是硫酸氢钠和亚硫酸氢钠,二者发生反应的离子方程式是HSO3- + H+ = H2O + SO2↑;Ba(OH)2溶液中逐滴加入硫酸氢钠溶液至中性的离子方程是Ba2+ + 2OH- +2H+ + SO42- = BaSO4↓+ 2H2O。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| △ |
| ||
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||||
| Z | M | R | |||
| A、元素X和Y可以形成两种以上的气态化合物 |
| B、原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C、元素的最高价氧化物对应水化物的酸性R强于M |
| D、加热蒸干由元素R和Z形成的化合物的水溶液可以得到该化合物的晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com