
| A. | 可能存在NaCl | B. | 可能存在Na2SO4 | C. | 一定存在FeCl3 | D. | 一定存在Ba(NO3)2 |
分析 该废液样品观察为无色溶液,则一定不含FeCl3,向其中滴加BaCl2溶液产生白色沉淀,继续加稀硝酸无明显现象,则白色沉淀为BaSO4,可知一定含Na2SO4,以此来解答.
解答 解:该废液样品观察为无色溶液,则一定不含FeCl3,向其中滴加BaCl2溶液产生白色沉淀,继续加稀硝酸无明显现象,则白色沉淀为BaSO4,可知一定含Na2SO4,Na2SO4、Ba(NO3)2反应不能共存,则原溶液不含Ba(NO3)2,不能确定是否含NaCl,综上所述,一定含Na2SO4,一定不含FeCl3、Ba(NO3)2,不能确定含NaCl,
故选A.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与推断能力的考查,注意氯化铁的颜色及白色沉淀的判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
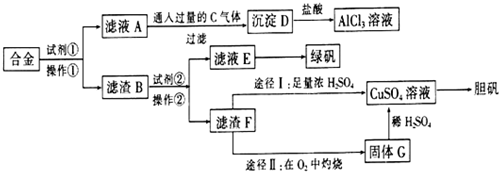
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体和溶液都是均一、稳定的分散系,静置不易产生沉淀 | |
| B. | 胶体与纳米级微粒在直径上具有相同数量级 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 向Fe(OH)3胶体中逐滴加入稀硫酸无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑤ | C. | ①②③ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH4+的质量为18g | |
| B. | SO2的摩尔质量为64g•mol-1 | |
| C. | 铝原子的摩尔质量等于它的相对原子质量 | |
| D. | 一个水分子的质量约等于$\frac{18}{6.02×1{0}^{23}}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
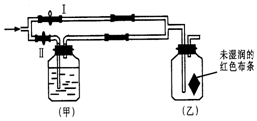 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( ) | A. | ① | B. | ②③④ | C. | ①③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液 | |
| C. | 正极为Fe,负极为Cu,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Zn,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把浑浊的液体倒入蒸发皿中加热 | B. | 开始析出晶体后用玻璃棒搅拌 | ||
| C. | 待水分完全蒸干后停止加热 | D. | 蒸发皿中出现多量固体时停止加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com