
【题目】常温下,用0.100mol/L的NaOH溶液分别滴定20.00mL0.100mol/L的盐酸和0.100mol/L的醋酸,得到两条滴定曲线,如图所示:
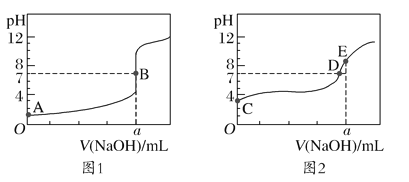
下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.两次滴定均可选择甲基橙或酚酞作指示剂
C.达到B、E点时,反应消耗的n(CH3COOH)=n(HCl)
D.以HA表示酸,当0mL<V(NaOH)<20.00mL时,图2对应混合液中各离子浓度由大到小的顺序一定是c(A-)>c(Na+)>c(H+)>c(OH-)
【答案】C
【解析】
A.醋酸是弱电解质、HCl是强电解质,物质的量浓度相等的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,则pH:醋酸![]() 盐酸,根据图象知,图1是滴定盐酸、图2是滴定醋酸,A错误;
盐酸,根据图象知,图1是滴定盐酸、图2是滴定醋酸,A错误;
B.甲基橙的变色范围是3.1~4.4、酚酞的变色范围是8.2~10.0,由图2中pH突变的范围(pH>7)可知,当氢氧化钠溶液滴定醋酸时,只能选择酚酞作指示剂,B错误;
C.B、E两点对应消耗氢氧化钠溶液的体积均为a mL,所以反应消耗的n(CH3COOH)=n(HCl),C正确;
D.当0mL<V(NaOH)<20.00mL时,图2对应的是NaOH滴定CH3COOH,混合溶液可能显中性,此时c(A-)=c(Na+)>c(H+)=c(OH-),D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】中和热的测定是重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从图中实验装置看,其中尚缺少的两种玻璃用品是_____________,为保证该实验成功,该同学采取了许多措施,如图的泡沫塑料块的作用在于________________
(2)倒入NaOH溶液的正确操作是:_______(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)实验记录数据如表
项目 | 反应起始温度T1(℃) | 终止温度T2(℃) | T2-T1 | ||
HCl | NaOH | 平均温度 | |||
第1次 | 26.2 | 26.0 | 29.4 | ||
第2次 | 27.0 | 27.4 | 32.2 | ||
第3次 | 25.9 | 25.9 | 29.1 | ||
第4次 | 26.4 | 26.2 | 29.7 | ||
设0.55mol/LNaOH溶液和0
(4)不能用醋酸代替盐酸做此实验,原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的叙述中,正确的是( )
A.检验溴乙烷中的溴元素,加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成
B.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+ CO2 + H2O→2C6H5OH +![]()
C.苯酚能与FeCl3溶液反应生成紫色沉淀
D.苯酚有强腐蚀性,沾在皮肤上可用酒精清洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图,请按要求填空:

(1)通入CH3CH2OH的电极名称是______________,B电极的名称是_____________。
(2)通入CH3CH2OH一极的电极反应式为_____________________________________。
(3)乙池中总反应的化学方程式为___________________________________________。
(4)当乙池中A(Fe)极的质量增加12.8g时,甲池中消耗O2 _______ mL(标况下)
(5)火箭发射时可用肼(N2H4)为燃料,以二氧化氮做氧化剂,它们相互反应生成氮气和水蒸气。
①写出在碱性条件下负极反应式为:___________________________________________。
②已知:N2(g)+2O2(g)=2NO2(g),ΔH=+67.7 kJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g),ΔH=-534 kJ·mol-1,则N2H4和NO2反应的热化学方程式__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
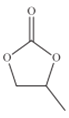
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。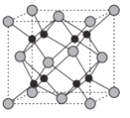
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取A4.5g,升温使其汽化,测其密度是相同条件下H2的45倍。 | A的相对分子质量为:___。 |
(2)将此4.5gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g。 | A的分子式为:___。 |
(3)另取A4.5g,跟足量的NaHCO3粉末反应,生成1.12LCO2(标准状况),若与足量金属钠反应则生成1.12LH2(标准状况)。 | 写出A中含有的官能团___、__。 |
(4)A的核磁共振氢谱如图: | 综上所述,A的结构简式为___。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学是预防污染的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(1)下列各项符合“绿色化学”要求的是________(填序号)。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)某化工厂排放的污水中含有![]() 、
、![]() 、
、![]() 、
、![]() 四种离子。某同学设计了从该污水中回收金属铜的方案。
四种离子。某同学设计了从该污水中回收金属铜的方案。
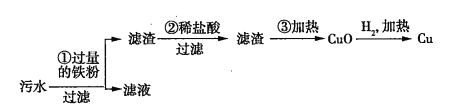
在回收金属铜的方案中,操作_______会导致环境污染,为防止污染,应采取的措施是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科技日报网报道南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现丙烯醇高效、绿色合成。丙烯醇及其化合物可合成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的电子排布式为___。
(2)1molCH2=CH-CH2OH中σ键和π键的个数比为___,丙烯醇分子中碳原子的杂化类型为___。
(3)丙醛(CH3CH2CHO的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是___。
(4)羰基镍[Ni(CO)4]用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是___。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]-和[Ni(CN)2]2-等。[Ni(NH3)6]2+中心原子的配位数是___,与SCN-互为等电子体的分子为___。
(6)“NiO”晶胞如图所示。
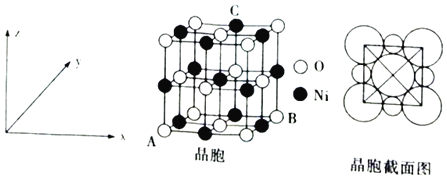
①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为___。
②已知:氧化镍晶胞密度为dgcm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为___nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨是最重要的氮肥,是产量最大的化工产品之一。在1L密闭容器中,起始投入4mol N2和6mol H2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示 (已知:T1<T2)
温度 | 平衡时NH3的物质的量/mol |
T1 | 3.6 |
T2 | 2 |
①则K1_______K2 (填“>”、“<”或“=”),原因:__________。
②在T2下,经过10s达到化学平衡状态,则平衡时H2的转化率为______________。若再同时增加各物质的量为1mol,则该反应的速率v正_____v逆(>或=或<),平衡常数将______(填“增大”、“减小”或“不变)。
(2)一定温度下,将3mol A气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:
3A(g)+B(g)![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
①反应1min时测得剩余1.8mol A,C的浓度为0.4 mol/L,则1min内B的反应速率为______,x为_______。
②若混合气体起始压强为P0,10min后达平衡,容器内混合气体总压强为P,用P0、P来表示达平衡时反应物A的转化率a(A)为__________。
③能够说明该反应达到平衡的标志是___________。
A 容器内混合气体的密度保持不变
B v(A)=3v(B)
C A、B的浓度之比为3:1
D 单位时间内消耗3 n molA的同时生成n mol B
E 体系的温度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com