
【题目】下列根据各概念图作出的判断,不正确的是
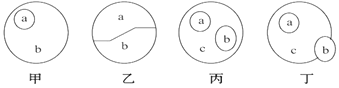
A. 甲图中a和b可以表示核糖和单糖的关系
B. 若乙中a和b分别代表DNA和RNA,则乙图可以代表原核细胞内的核酸
C. 丙图中a、b、c可分別表示磷脂、固醇和脂质之间的关系
D. 丁图a、b、c可分别表示激素、酶和蛋白质之间的关系
【答案】D
【解析】
原核生物包括蓝藻(如颤藻、发菜、念珠藻)、细菌(如乳酸菌、硝化细菌、大肠杆菌等)、支原体、放线菌等;细胞中的化合物主要有糖类、脂质、蛋白质和核酸,其中糖类包括单糖、二糖和多糖;脂质包括脂肪、磷脂和固醇;绝大多数酶是蛋白质,极少数酶是RNA,有些激素是蛋白质。
A. 核糖属于单糖,甲图中a和b可以表示核糖和单糖的关系,A正确;
B. 原核生物含有2种核酸,若乙中a和b分别代表DNA和RNA,则乙图可以代表原核细胞内的核酸,B正确;
C. 脂质包括脂肪、磷脂和固醇,丙图中a、b、c可分別表示磷脂、固醇和脂质之间的关系,C正确;
D. 绝大多数酶是蛋白质,极少数酶是RNA,有些激素是蛋白质,故丁图a、b、c不能表示激素、酶和蛋白质之间的关系,D错误。


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】镭是周期表中第7周期第ⅡA主族元素,下列关于镭的性质描述中不正确的是( )
A.在化合物中呈+2价
B.镭比钙的金属性强
C.氢氧化物呈两性
D.碳酸盐难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在工农业生产及日常生活中有重要用途。请回答下列问题:
(1)Al原子的价电子排布图为_________________________________,Na、Mg、Al的第一电离能由小到大的顺序为________________________。
(2)某含有铝元素的翡翠的化学式为Be3Al2(Si6O18),其中Si原子的杂化轨道类型为________。
(3)工业上用氧化铝、氮气、碳单质在高温条件下可制备一种四面体结构单元的高温结构陶瓷,其晶胞如图所示:
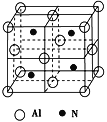
①该制备反应的化学方程式为___________________________________.
②该化合物的晶体类型为_______________,该晶胞中有____个铝原子,该晶胞的边长为a pm,则该晶胞的密度为____________g·cm-3。
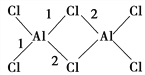
(4)AlCl3的相对分子质量为133.5,183 ℃开始升华,易溶于水、乙醚等,其二聚物(Al2Cl6)的结构如图所示,图中1键键长为206 pm,2键键长为221 pm,从键的形成角度分析1键和2键的区别:__________________________________________。
(5)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇:
CH3COOH ![]() CH3CH2OH
CH3CH2OH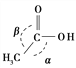
CH3COOH分子中π键和σ键的数目之比为________,分子中键角α________键角β(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含卤族元素的化合物在科研和生产中有许多重要用途。如:2molSb(CH3)3、2mol Sb (CH3)2Br和2 molSb(CH3)Br2进行重组反应可生成空间位阻最小的离子化合物[Sb2(CH3)5]2[Sb2(CH3)2Br6]。请回答:
(1)  中,H、C、Br的电负性由大到小的顺序为________,溴原子的M能层电子排布式为________。
中,H、C、Br的电负性由大到小的顺序为________,溴原子的M能层电子排布式为________。
(2)[Sb2(CH3)5]+的结构式为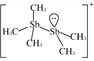 ,Sb原子的杂化轨道类型为_________。写出一种与CH
,Sb原子的杂化轨道类型为_________。写出一种与CH![]() 互为等电子体的阳离子_________。
互为等电子体的阳离子_________。
(3)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于发生I-+I2![]() I
I![]() 。I
。I![]() 离子的空间构型为__________。
离子的空间构型为__________。
(4)一定条件下SbCl3与GaCl3以物质的量之比为l:l混合得到一种固态离子化合物,其结构组成可能为:(a)[SbCl![]() ][GaCl
][GaCl![]() ]或(b)[GaCl
]或(b)[GaCl![]() ][SbCl
][SbCl![]() ],该离子化合物最可能的结构组成为________ (填“a”或“b”),理由是_____________________________。
],该离子化合物最可能的结构组成为________ (填“a”或“b”),理由是_____________________________。
(5)固态PCl5结构中存在PCl![]() 和PCl
和PCl![]() 两种离子,其晶胞如图所示。
两种离子,其晶胞如图所示。
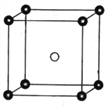
已知晶胞的边长为a nm,阿伏加德罗常数值用NA表示。则PCl![]() 和PCl
和PCl![]() 之间的最短距离为_______pm,固态PCl5的密度为______gcm-3。
之间的最短距离为_______pm,固态PCl5的密度为______gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内,某些重要化合物的元素组成及相互关系十分密切。请据右图
分析完成下列问题。

(1)图中X、Y分别代表何种元素?X ,Y 。
(2)请在B下面的括号内填写该类物质的另外三种功能。
(3)B类物质有多种不同功能,究其原因是因为A类物质内的 不同。
(4)细胞内遗传信息的携带者是图中的 物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
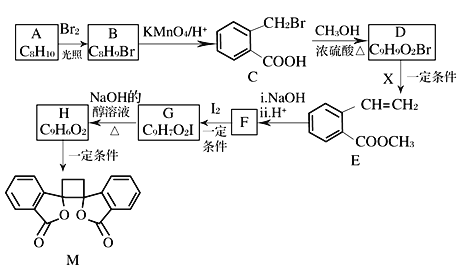
【题目】我国北方的山岗荒坡间有一种草本植物,别名奈何草,其中含有抗菌作用的某有机物M的合成路线如下图所示:
已知:ⅰ.RCH2Br![]() R—HC=CH—R'
R—HC=CH—R'
ⅱ.R—HC=CH—R' ![]()
![]()
ⅲ.R—HC=CH—R' ![]()
![]() (以上R、R'、R″代表氢、烷基或芳基等)
(以上R、R'、R″代表氢、烷基或芳基等)
(1)A的化学名称为_____,B的核磁共振氢谱显示为_____组峰。
(2)由C生成D的反应类型为_____。
(3)1 mol M与足量NaOH溶液反应,消耗_____mol NaOH。
(4)X的结构式为_____,F的结构简式为_____________。
(5)由G生成H的化学方程式为_______________________________。
(6)符合下列条件的E的同分异构体共_____种(不考虑立体异构)。
①芳香族化合物 ②与E具有相同官能团 ③能发生银镜反应 ④酸性条件下水解产物遇氯化铁溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序不正确的是( )
A.元素的非金属性:N<O<F
B.酸性:HClO4>H2SO4>H3PO4
C.热稳定性:HF>HCl>H2S
D.原子半径:Al>Mg>Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不符合节能减排的是( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
请完成下列填空:
(1)写出一个包含上述体系中七种物质的氧化还原反应方程式(无需配平):_________________________;上述反应中,还原产物是_____________,每转移1 mol电子,生成Cl2 _____ L(标准状况)。
(2)上述反应体系中,有些短周期元素的简单离子核外电子排布相同,它们的简单离子半径由大到小的顺序为______________(用离子符号表达)。
(3)氯原子的最外层电子排布式为_____________________,氯原子核外共有____种不同运动状态的电子。
(4)在上述反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。比较该反应中的氧化剂和氧化产物的氧化性强弱_______>________。
(5)请用原子结构理论解释上述含7种物质的氧化还原反应体系中,属于同一主族两种元素非金属性的强弱,____>______;______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com