


 .
. 分析 乙烯与HBr发生加成反应生成2为CH3CH2Br,结合信息可知,CH3CH2Br与NaCN发生取代反应生成3为CH3CH2CN,CH3CH2CN水解得到4为CH3CH2COOH,CH3CH2COOH在Br2/P条件下发生取代反应生成5为CH3CHBrCOOH,CH3CHBrCOOH在氢氧化钠醇溶液条件下发生消去反应,再酸化得到6为CH2=CHCOOH,CH2=CHCOOH与甲醇发生酯化反应生成7为CH2=CHCOOCH3,CH2=CHCOOCH3发生加聚反应生成聚合物8为 ,据此解答.
,据此解答.
解答 解:乙烯与HBr发生加成反应生成2为CH3CH2Br,结合信息可知,CH3CH2Br与NaCN发生取代反应生成3为CH3CH2CN,CH3CH2CN水解得到4为CH3CH2COOH,CH3CH2COOH在Br2/P条件下发生取代反应生成5为CH3CHBrCOOH,CH3CHBrCOOH在氢氧化钠醇溶液条件下发生消去反应,再酸化得到6为CH2=CHCOOH,CH2=CHCOOH与甲醇发生酯化反应生成7为CH2=CHCOOCH3,CH2=CHCOOCH3发生加聚反应生成聚合物8为 .
.
(1)A.化合物3为CH3CH2CN,不含羧基,故不选;
B.化合物4为CH3CH2COOH,含有羧基,故选;
C.化合物6为CH2=CHCOOH,含有羧基,故选;
D.化合物7 CH2=CHCOOCH3,不含羧基,故不选,
故选:BC;
(2)化合物4→8的合成路线中,依次发生的取代反应、消去反应、酯化反应(属于取代反应)、加聚反应,未涉及还原反应,
故选:D;
(3)CH3COOC2H5 属于酯,C6H5COOH属于芳香酸,CH3CH2CH2COOH CH3COOH,属于脂肪酸,均含有1个羧基,组成相差2个CH2原子团,二者互为同系物,
故选:CD;
(4)化合物4为CH3CH2COOH,属于酯类的所有同分异构体有:HCOOCH2CH3、CH3COOCH3,
故答案为:HCOOCH2CH3、CH3COOCH3;
(5)化合物7→8的化学方程式为n CH2=CHCOOCH3$\stackrel{催化剂}{→}$ ,故答案为:n CH2=CHCOOCH3$\stackrel{催化剂}{→}$
,故答案为:n CH2=CHCOOCH3$\stackrel{催化剂}{→}$ .
.
点评 本题考查有机物推断,根据反应条件利用顺推法进行推断,需要学生熟练掌握官能团的性质与转化,难度不大.


科目:高中化学 来源: 题型:解答题
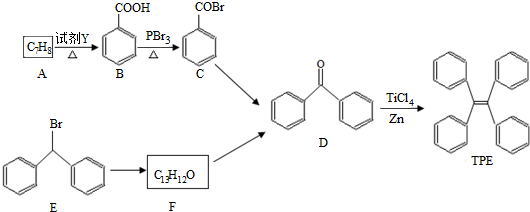
 ;
; )的一元取代物;②存在羟甲基(-CH2OH),写出W所有可能的结构简式:
)的一元取代物;②存在羟甲基(-CH2OH),写出W所有可能的结构简式: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.
利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=c(Na+)+c(H+) | |
| B. | 该溶液中的c(OH-)=1.0×10-3mol•L-1 | |
| C. | 加水稀释104倍所得溶液显碱性 | |
| D. | 与pH=3的HF溶液等体积混合所得溶液:c(Na+)=c(F-)+c(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在醋酸溶液中,NH4+、Na+、SiO32-、C2O42-能大量共存 | |
| B. | 与Na2S2O3溶液反应的离子方程式:S2O32-+2H+═S↓+SO2↑+H2O | |
| C. | 常温下,加水稀释醋酸,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| D. | 该醋酸溶液中c(CH3COO-)<0.001 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
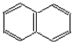
 并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )
并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )| A. | 4 | B. | 6 | C. | 7 | D. | 11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com