
| A. | 某溶液的pH<7,说明该溶液一定呈酸性 | |
| B. | 常温时pH=3的盐酸溶液与pH=5盐酸溶液等体积混合后溶液的pH=4 | |
| C. | 0.2 mol•L-1的盐酸,与等体积水混合后pH=1 | |
| D. | 常温时pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
分析 A、100℃时,pH=6的溶液显中性;
B、酸溶液混合,先计算混合后溶液中氢离子的物质的量,再根据c=$\frac{n}{V}$计算氢离子的物质的量浓度,最后根据pH=-lgc(H+)计算出混合液的pH;
C、0.2 mol•L-1的盐酸与等体积水混合后,混合后溶液的体积是原来的2倍,所以氢离子的浓度是原来的一半;
D、pH=3的醋酸溶液,与pH=11的氢氧化钠溶液中:c(H+)=c(OH-)=1×10-3mol/L,但醋酸为弱酸,不完全电离,醋酸浓度大.
解答 解:A、100℃时,pH=6的溶液显中性,故pH<7的溶液不一定显酸性,故A错误;
B、pH=3的盐酸和pH=5的硫酸等体积混合后,设体积均为VL,
混合液中氢离子的物质的量为:n(H+)=VL×10-3mol/L+VL×10-5mol/L≈10-3Vmol,
则混合溶液中氢离子浓度为:c(H+)=$\frac{1{0}^{-3}mol/L}{2VL}$=5×10-4mol/L,
所以pH=-lg5×10-4=4-lg5=3.3,故B错误;
C、0.2 mol•L-1的盐酸与等体积水混合后,混合后溶液的体积是原来的2倍,所以氢离子的浓度是原来的一半,所以与等体积水混合后c(H+)=0.1 mol/L,故C正确;
D、pH=3的醋酸溶液,与pH=11的氢氧化钠溶液中:c(H+)=c(OH-)=1×10-3mol/L,但醋酸为弱酸,不完全电离,醋酸浓度大,与pH=11的氢氧化钠溶液等体积混合后,醋酸过量,溶液pH<7,故D错误;
故选C.
点评 本题考查了水的电离平衡影响因素,溶液pH计算,酸与碱混合后溶液pH的判断,其中B选项学生要注意醋酸是弱电解质,醋酸溶液中存在大量的醋酸分子,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6个碳原子有可能都在一条直线上 | B. | 有5个碳原子可能在一条直线上 | ||
| C. | 6个碳原子一定都在同一平面上 | D. | 6个碳原子不可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1所示装置可制备氢氧化亚铁 | |
| B. | 图2所示装置可电解食盐水制氢气和Cu(OH)2 | |
| C. | 图3所示装置可验证氨气极易溶于水 | |
| D. | 图4所示装置用于Cu和浓硫酸反应制取少量的SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种元素形成的离子半径与原子半径大小顺序相同 | |
| B. | Z是地壳中含量最多的元素 | |
| C. | M、N、R晶体类型相同 | |
| D. | 少量M、N投入水中所得溶液的溶质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试样$→_{水浴加热}^{银氨溶液}$产生银镜结论:该试样是醛类 | |
| B. | 某卤代烃试样$→_{加热}^{氢氧化钠溶液}$$\stackrel{滴入硝酸银溶液}{→}$最终的沉淀不是白色.结论:该卤代烃中不含氯原子 | |
| C. | 某溶液$\stackrel{打开瓶盖}{→}$冒着白雾$\stackrel{用蘸有浓氨水玻璃棒}{→}$产生大量白烟,结论:此溶液为浓盐酸 | |
| D. | 无色溶液$\stackrel{焰色反应}{→}$呈黄色:结论:此溶液一定含有钠元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 54 g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA | |
| B. | 同温同压下,NA个NO2与NA个N2和O2的混合气体的体积不相等 | |
| C. | 1 mol•L-1的MgCl2溶液中,含有Cl-个数为2NA | |
| D. | 11.2 L氧气中所含有的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
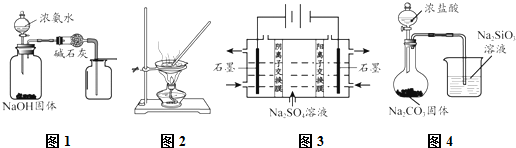
| A. | 用图1所示装置制取并收集干燥纯净的NH3 | |
| B. | 用图2所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 用图3所示装置制硫酸和氢氧化钠 | |
| D. | 用图4所示装置比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com