
| A. | 碳原子数 | B. | 烷基位置编号 | C. | 氢原子数 | D. | 同种烷基数目 |
分析 依据有机物的命名原则和书写方法分析判断;找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙…)代表碳数,碳数多於十个时,以中文数字命名,如:十一烷. 从最近的取代基位置编号:1、2、3…(使取代基的位置数字越小越好).以数字代表取代基的位置.数字与中文数字之间以-隔开.
有多个取代基时,以取代基数字最小且最长的碳链当主链,并依甲基、乙基、丙基的顺序列出所有取代基.
有两个以上的取代基相同时,在取代基前面加入中文数字:一、二、三…,如:二甲基,其位置以,隔开,一起列于取代基前面.
解答 解:有机物命名中常使用三套数字,甲、乙、丙…,是主链碳原子数;1、2、3…,是取代基在主链上的位次;一、二、三…,为取代基的数目;
故选D.
点评 本题考查了系统命名原则和方法应用,注意殛的数目、位次表示,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等 | |
| B. | 10g浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA | |
| C. | 2 g H2分别与足量的C12和N2充分反应后转移的电子数均为2NA | |
| D. | 1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
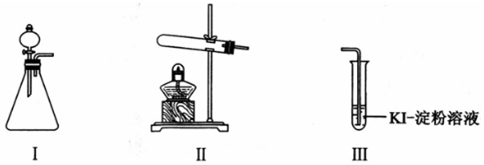
| 操作 | 现象 | |
| 甲 | 向I的锥形瓶中加入MnO2固体,.向I的分液漏斗中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的硫酸溶液中含有的SO42-数目为0.05NA | |
| B. | 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA | |
| C. | 100mL 1mol/L CH3COONa 溶液中含有的CH3COO-数目为0.1NA | |
| D. | 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋浸泡可除去水垢 | |
| B. | 用浓烧碱溶液作蚊虫叮咬处的淸洗剂 | |
| C. | 用明矾溶液的酸性淸除铜镜表面的铜锈 | |
| D. | 用浸泡过高锰酸钾溶液的硅土保存水果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com