
| A. | Cu+2 H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| B. | 2Na+H2SO4═Na2 SO4+H2↑ | |
| C. | 3S+6NaOH $\frac{\underline{\;\;△\;\;}}{\;}$ 2Na2S+Na2SO3+3H2O | |
| D. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$ 2NaCl |
分析 根据元素的化合价的变化,判断氧化剂和还原剂,结合物质的量的关系从化合价的角度分析.
解答 解:A.H2SO4反应中为氧化剂,Cu为还原剂,由反应可知,H2SO4并不都表现氧化性,则氧化剂和还原剂物质的量之比为1:1,故A正确;
B.H2SO4反应中为氧化剂,Na为还原剂,由反应可知,氧化剂和还原剂物质的量之比为1:2,故B错误;
C.只有S元素化合价发生变化,如3molS参加反应,生成2molNa2S,1molNa2SO3,氧化剂与还原剂的物质的量之比为2:1,故C错误;
D.氧化剂为Cl2,还原剂为Na,氧化剂与还原剂的物质的量之比为1:2,故D错误.
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化剂、还原剂判断及物质的量关系的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.3 g Na变成Na2O2时,失去0.2NA个电子 | |
| B. | 常温常压下,32 g氧气和32 g臭氧都含有2NA个氧原子 | |
| C. | 含0.2 mol NaOH的溶液中含有NA个Na+离子 | |
| D. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只能含有离子键 | |
| B. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 | |
| C. | 化学键存在于分子之间 | |
| D. | 共价化合物中可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
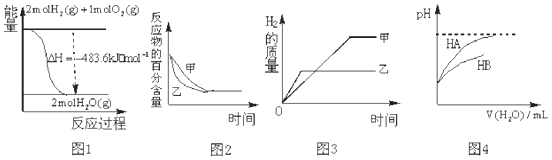
| A. | 图 1 表示 H2与O2发生反应过程中的能量变化,则H2的燃烧热为 241.8kJ•mol-1 | |
| B. | 图 2 表示压强对可逆反应 2A(g)+2B (g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 图 3 表示等质量的钾、钠分别与足量水反应,则甲为钠 | |
| D. | 图 4 表示常温下,稀释 HA、HB 两种酸的稀溶液时,溶液 pH 随加水量的变化,则相同条件下 NaA溶液的 pH 大于同浓度的 NaB 溶液的 pH. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 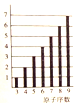 图纵坐标为元素的最高正价 | |
| B. |  图可说明反应2NO+2CO=N2+2CO2为吸热反应 | |
| C. | 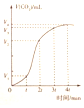 若图表示的是一定量的CaCO3与盐酸反应生成CO2的体积随时间的变化,则t~2tmin反应速率最快 | |
| D. | 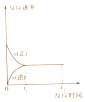 若图表示的是反应N2(g)+3H2(g)?2NH3(g)的.v(正)、v(逆)随时间的变化,则0~t1时间段:v(正)=v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
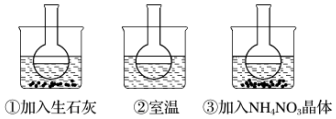
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
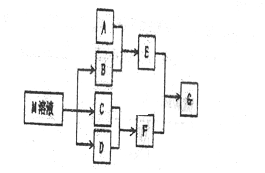
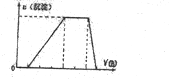
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com