
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 2014 年西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火 | |
| D. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
分析 A.根据标有使用温度的仪器有:滴定管、容量瓶、量筒、烧杯等;根据标有“0”刻度的仪器有:滴定管、托盘天平、温度计等;根据滴定管的使用事项等方面进行解答;
B.乙醇没有强氧化性;
C.灭火的方法有:(1)与空气(或氧气)隔绝.(2)降温到可燃物的着火点以下.(3)撤走可燃物;
D.K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+.
解答 解:A.容量瓶、量筒和滴定管上都标有刻度,使用时避免热胀冷缩,所以标有使用温度,量筒“0”刻度就是底座、容量瓶只有最大容量的一个刻度,所以两者都无“0”刻度,使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗因还需加水定容,故A正确;
B.乙醇没有强氧化性,但是乙醇能使细菌的蛋白质变性,从而起到消毒的目的,次氯酸钠溶液可以将病毒氧化而达到消毒的目的,故B正确;
C.泡沫灭火器灭火时喷出的泡沫中含有水分,容易在电器短路灭火时导致触电及损坏电器,所以不可用泡沫灭火器灭火,故C正确;
D.K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,滴加数滴1mol/LNaOH溶液,平衡正向移动,则溶液颜色从橙色变成黄色,故D正确.
故选B.
点评 本题考查常见仪器的使用、化学平衡移动原理的应用,题目难度不大,注意常见化学仪器的使用方法和注意事项,侧重于考查学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 甲、乙中都是铝过量 | B. | 甲中铝不足、乙中铝过量 | ||
| C. | 甲中酸过量、乙中铝过量 | D. | 甲中酸过量、乙中铝过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被还原 | B. | 被氧化 | ||
| C. | 有可能被氧化,也有可能被还原 | D. | 由高价态变为零价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| B. | 碱金属Cs与水反应时增大水的用量 | |
| C. | Fe与稀硫酸反应制取氢气时,改用浓硫酸 | |
| D. | Al与盐酸反应,加几滴氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
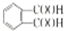 .
.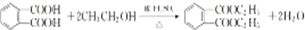 .
.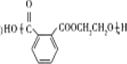 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
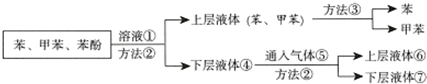
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答: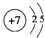 .
.| 气体 | QZ2 | Z2 | QZ3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com