
| A. | ④>①>③>② | B. | ①>④>③>② | C. | ①=④>③=② | D. | ④=①>③>② |
分析 先根据n=CV计算溶质的物质的量,再根据溶质的电离和水解分析带电微粒的多少.
①Na2SO4是强电解质,在水溶液中完全电离出钠离子和硫酸根,不能水解;
②H2SO3是二元弱酸,在溶液中的电离分两步进行;
③NaHSO3是强电解质,但在溶液中只能完全电离为钠离子和硫酸氢根离子,硫酸氢根离子在溶液中既能水解又能电离;
④Na2S是强电解质,在溶液中完全电离为钠离子和硫离子,硫离子是二元弱酸根,在溶液中水解分两步进行.据此分析.
解答 解:等体积,等物质的量浓度的4种稀溶液,根据n=CV知,各溶质的物质的量相等.
Na2SO4、NaHSO3、Na2S是强电解质,在水中完全电离;Na2SO4、Na2S中阳离子和阴离子个数比为2:1,NaHSO3中阳离子和阴离子个数比为1:1,所以硫酸钠和硫化钠的溶液中阴阳离子数大于亚硫酸氢钠溶液中的阴阳离子数;硫酸钠是强酸强碱盐,在水中不水解,硫化钠是强碱弱酸盐,在水中水解导致溶液中带电荷的微粒数增多,所以硫化钠溶液中的带电微粒数大硫酸钠溶液中的带电微粒数;H2SO3是弱电解质,只有部分电离,所以H2SO3溶液中带电微粒数最少,所以①Na2SO4 ②H2SO3 ③NaHSO3 ④Na2S中含带电微粒数由多到少的顺序是④>①>③>②.
故选A.
点评 本题考查了溶液中带电微粒多少的判断,题目难度中等,注意把握盐的水解和弱酸的电离一般程度都较小,侧重于考查学生对水解知识和电离知识的应用能力.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 12g熔融NaHSO4中含有阳离子的总数为0.1NA | |
| B. | 0.1mol Cl2全部溶于水后转移电子的数目为0.1NA | |
| C. | 常温下,pH=2的醋酸溶液中所含有的H+数为0.01NA | |
| D. | 合成氨反应达平衡时,每断裂3NA个氮氮三键则必生成3NA个氢氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在强碱溶液中:Na+、K+、SO32-、CO32- | |
| C. | 在c(H+)=10-13 mol•L-1的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 在pH=1的溶液中:K+、I-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或客观事实 | 解 释 |
| A | 浸泡KMnO4溶液的硅土延长果实的成熟 | 利用乙烯可以发生加成反应 |
| B | 钾原子比钠原子更易失去电子 | 钾的核电荷数比钠的多 |
| C | SO2能使氯水褪色 | SO2具有还原性 |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2(g)+O2(g)═2N2O(g)△H=+163 kJ•mol-1 | |
| B. | 2Ag(s)+Cl2(g)═2AgCl(s)△H=-127 kJ•mol-1 | |
| C. | 2HgO(s)═2Hg(l)+O2(g)△H=+91 kJ•mol-1 | |
| D. | 2H2O2(l)═O2(g)+2H2O(l)△H=-98 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
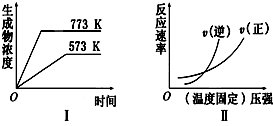
| A. | 2SO3(g)?2SO2(g)+O2(g)△H>0 | B. | N2(g)+3H2(g)?2NH3(g)△H<0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳是温室气体,但不是大气污染物 | |
| B. | 农村常用明矾净水,是利用了胶体的性质 | |
| C. | 食品添加剂对人体无害,可大量食用 | |
| D. | 氯化钠是常用的防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
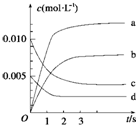 在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com