
【题目】某同学研究金属锌与氯化铜溶液之间反应,在实验中该同学观察到的现象有:
i.产生少量气泡;ii.有红色固体生成;iii.溶液中产生白色沉淀。
为了解释上述现象,某同学查阅资料,获得如下信息:
编号 | 化学反应离子方程式 |
1 | Zn+Cu2+ |
2 | Zn+2Cu2+ |
3 | Cu++2Cl- |
4 | Cu++Cl- |
(1)请结合离子方程式解释产生少量气泡的原因:___。
(2)Zn与CuCl2反应生成白色沉淀的离子方程式是___。
(3)为了探究影响生成白色沉淀的因素,该同学进一步实验。取不同浓度CuCl2溶液,加入锌并振荡,均立刻产生少量气泡和红色固体,其他实验现象如下。
| 编号 | 浓度(rnol/L) | 试剂(锌均过量) | 实验现象 |
a | 0.5 | 锌片 | 立刻出现少量白色沉淀 | |
b | 1 | 锌片 | 立刻出现白色沉淀 | |
1 | 锌粉 | 立刻出现大量白色沉淀 | ||
d | 1 | 锌片、适量NaCl固体 | 少量白色沉淀,振荡迅速溶解 |
①对比实验a、b,实验结论是___。
②某同学从化学平衡的角度分析,d中白色沉淀溶解可能的原因是___(用离子方程式表示)。为证明该同学分析的原因正确,向b试管中加入适量___,振荡,观察到___,证明该同学分析的原因正确。
(4)利用沉淀法除去杂质在实际生产中应用广泛。
①在工业中冶炼锌,为了除去ZnSO4电解液溶液中的C1-,可加入___和___,生成沉淀而除去。
②通过进一步查阅资料得知:CuCl的形成与溶液的pH及Cu2+等离子浓度有关,一定条件下,通过实验得出pH、Cu2+浓度对Cl-沉淀的影响如图所示:
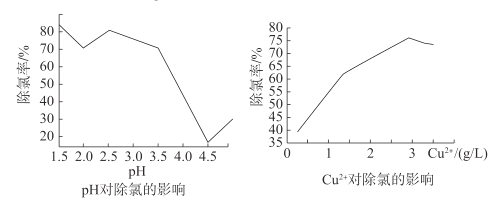
根据图,除去该电解液中Cl-的最佳条件是___。
【答案】铜离子水解呈酸性,Cu2++2H2O![]() Cu(OH)2+2H+,锌与水解产生的氢离子反应,产生气泡; Zn+2Cu2++2Cl-= Zn2++2CuCl↓ 当锌的形状相同时,氯化铜浓度越高,生成沉淀的反应速率越快 Cu++2Cl-
Cu(OH)2+2H+,锌与水解产生的氢离子反应,产生气泡; Zn+2Cu2++2Cl-= Zn2++2CuCl↓ 当锌的形状相同时,氯化铜浓度越高,生成沉淀的反应速率越快 Cu++2Cl-![]() CuCl
CuCl![]() 锌粉 沉淀溶解 锌单质 铜离子 pH=1.5,铜离子浓度为3g/L
锌粉 沉淀溶解 锌单质 铜离子 pH=1.5,铜离子浓度为3g/L
【解析】
(1)氯化铜是强酸弱碱盐,铜离子水解呈酸性,锌与氢离子反应产生气泡,故本题答案为:铜离子水解呈酸性,Cu2++2H2O![]() Cu(OH)2+2H+,锌与水解产生的氢离子反应,产生气泡;
Cu(OH)2+2H+,锌与水解产生的氢离子反应,产生气泡;
(2)Zn与CuCl2反应生成ZnCl2和CuCl,离子方程式为:Zn+2Cu2++2Cl-= Zn2++2CuCl↓,故本题答案为:Zn+2Cu2++2Cl-= Zn2++2CuCl↓;
(3)①对比实验a、b,锌片相同时,氯化铜浓度增加,生成沉淀的反应速率加快,故实验结论是:当锌的形状相同时,氯化铜浓度越高,生成沉淀的反应速率越快;
②d中白色沉淀溶解可能是加入氯化钠后,增加了氯离子浓度,促进反应Cu++2Cl-![]() CuCl
CuCl![]() 正向进行,为证明该同学分析的原因正确,可向b试管中加入适量锌粉,振荡,观察到沉淀溶解,证明该同学分析的原因正确,故本题答案为:Cu++2Cl-
正向进行,为证明该同学分析的原因正确,可向b试管中加入适量锌粉,振荡,观察到沉淀溶解,证明该同学分析的原因正确,故本题答案为:Cu++2Cl-![]() CuCl
CuCl![]() ;锌粉;沉淀溶解;
;锌粉;沉淀溶解;
(4)①在工业中冶炼锌,为了除去ZnSO4电解液溶液中的C1-,可加入锌单质和铜离子,发生Zn+2Cu2+![]() Zn2++2Cu+,再发生Cu++Cl-
Zn2++2Cu+,再发生Cu++Cl-![]() CuCl↓,生成沉淀而除去,故本题答案为:锌单质;铜离子;
CuCl↓,生成沉淀而除去,故本题答案为:锌单质;铜离子;
②由图可知,当pH等于1.5,铜离子浓度为3g/L时,氯离子去除率均较高,故本题答案为:pH=1.5,铜离子浓度为3g/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,![]() 的最高正价与最低负价的代数和为2,下列说法正确的是( )
的最高正价与最低负价的代数和为2,下列说法正确的是( )
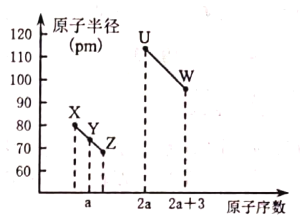
A.![]() 的最高价氧化物一定是酸性氧化物
的最高价氧化物一定是酸性氧化物
B.![]() 的单质是制造光导纤维的主要物质
的单质是制造光导纤维的主要物质
C.由![]() 和氢元素三种元素形成的化合物一定是共价化合物
和氢元素三种元素形成的化合物一定是共价化合物
D.X、U、W三种元素的氧化物对应的水化物酸性最强的是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为放热反应
B.达平衡时,容器Ⅱ中CH3OCH3的浓度大于0.16 mol/L
C.达平衡时,容器Ⅲ中![]() 比容器Ⅱ中的大
比容器Ⅱ中的大
D.若起始时向容器Ⅰ中充入CH3OH(g)0.30 mol、CH3OCH3(g)1.50 mol和H2O(g)0.30 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3,4-二羟基肉桂酸乙酯(I)具有抗炎作用和治疗自身免疫性疾病的潜力。由化合物A制备该物质的合成路线如下:
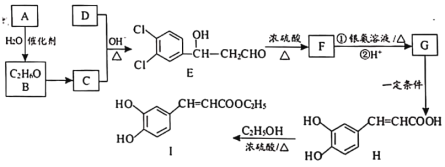
已知:R—CHO+R′—CH2—CHO![]()
![]()
回答下列问题:
(1)A的结构简式为___________。
(2)E生成F的反应类型为___________。
(3)下列有关H的说法中,不正确的是___________。
a.能使酸性高锰酸钾溶液褪色
b.1 mol H最多能和3 mol Br2反应
c.H分子中最多有9个碳原子共平面
d.l mol H分别与足量NaOH、NaHCO3反应时,消耗的NaOH、NaHCO3的物质的量之比为1:1
(4)写出C+D→E的化学方程式__________。
(5)已知W是H的同分异构体,符合下列条件的W结构共有________种。
①属于芳香族化合物。
②1 mol W与足量NaHCO3溶液反应生成气体44.8 L(标准状况)。其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为:_________。
(6)季戊四醇(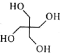 )是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A
)是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A |
| Zn保护了Fe不被腐蚀 |
B |
| 2NO2(g)N2O4(g)为吸热反应 |
C |
| 木炭与浓硝酸发生了反应 |
D |
| 碳酸钠的水解程度强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺如图所示,下列有关此工艺操作不正确的是
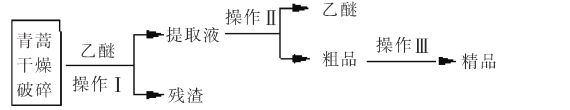
A.操作Ⅲ的主要过程是:加水溶解、蒸发浓缩、冷却结晶、过滤
B.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率
C.操作Ⅱ是蒸馏,利用了乙醚沸点低回收利用。
D.操作I需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某兴奋剂乙基雌烯醇的结构如图所示。下列叙述正确的是( )

A.该物质可以视为酚类
B.能使溴的四氯化碳溶液褪色
C.该物质分子中的所有碳原子均共面
D.在浓硫酸作用下,分子内消去一个水分子,产物有三种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“>”“<”表示下列各组能级的能量高低。
Ⅰ.(1)4s___3d;
(2)钙是人体所需的重要元素之一,有一种补钙剂——抗坏血酸钙的组成为Ca(C6H7O6)2·4H2O,其结构示意图如下:
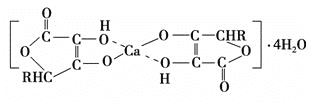
该物质中存在的化学键类型包括________(填字母)。
A.极性共价键 B.离子键 C.非极性共价键 D.配位键
Ⅱ.下列物质中:N2、H2O、Na2O、Ar、H2O2、KOH、NaF、Na2SO4
(1)只含有共价键的物质是______;
(2)只含有离子键的物质是______;
(3)既含有离子键,又含有共价键的物质______;
(4)不存在化学键的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL0.1mol/L的CH3COOH溶液中逐滴滴加0.1mol/L的NaOH溶液,溶液pH随NaOH溶液的体积变化如图所示。下列说法正确的是( )
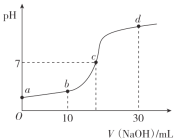
A.a点:pH=1
B.c点:V(NaOH)=20mL
C.b点:离子浓度的大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.a→d过程中,水电离出c(H+)不断增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com