
| A. | 是否为大量分子和离子的集合体 | B. | 能否通过滤纸或半透膜 | ||
| C. | 分散质粒子的大小 | D. | 是否均一、稳定、透明 |
分析 溶液、浊液、胶体三种分散系的分类依据是分散质粒子的直径大小,溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),丁达尔效应是胶体的特征性质,微粒大小比较,溶液和胶体通过滤纸,溶液通过半透膜,据此即可解答.
解答 解:A.胶体、浊液分散质都是微粒的集合体,故A错误;
B.胶体能透过滤纸但不能透过半透膜,是由分散质微粒的直径决定的,所以,该现象不是三种分散系的本质区别,故B错误;
C.根据分散质微粒直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以,溶液、胶体和浊液这三种分散系的本质区别在于分散质粒子直径大小,故C正确;
D.溶液均一、透明、稳定,胶体较稳定,浊液不稳定,是由分散质微粒的直径决定的,所以,该现象不是三种分散系的本质区别,故D错误;
故选C.
点评 本题考查了分散系溶液、浊液、胶体的区别,注意相关基础知识的积累,题目难度中等.


科目:高中化学 来源: 题型:解答题
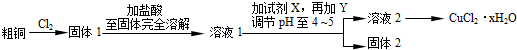
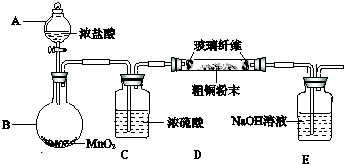
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
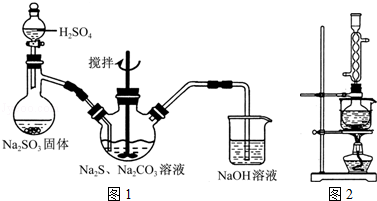
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑦ | B. | ②⑤⑦ | C. | ①②⑤⑥⑦ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 常温下,C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | 任何能使熵值增大的过程都能自发进行 | |
| D. | 反应物和生成物所具有的总焓决定了反应是否能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中有SO42- | |
| B. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 加入NaOH溶液有白色沉淀出现,则原溶液中一定含有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多余的氯气可以用氢氧化钠溶液吸收 | |
| B. | 用澄清的石灰石可以鉴别CO2和SO2 | |
| C. | SO2、Cl2都能使品红溶液褪色,其原理不同 | |
| D. | 铁丝在氯气中燃烧生成三价铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com