
| 选项 | 实验 | 现象 | 结论 |
| A | 将少量碳酸钙粉末加入到饱和NH4Cl溶液中 | 产生气体,粉末溶解 | NH4Cl水解使溶液呈酸性 |
| B | 将BaSO4固体粉末加入饱和Na2CO3溶液中,搅拌,过滤,洗涤,在滤渣中加入稀盐酸 | 产生气体,滤渣部分溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
| C | 将黑色氧化铜粉末进行高温加热 | 黑色变成红色 | CuO分解生成铜单质 |
| D | 将某溶液滴加过量的稀盐酸 | 有刺激性气味气体产生,溶液中出现沉淀 | 溶液中一定存在S2-和SO32- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸钙属于弱酸盐,能和强酸反应生成二氧化碳和水;
B.浓度商大于溶度积常数时产生沉淀;
C.加热条件下,Cu易与氧气反应生成CuO;
D.HS-和HSO3-都能与HCl反应生成有刺激性气味的气体.
解答 解:A.碳酸钙属于弱酸盐,能和强酸反应生成二氧化碳和水,将少量碳酸钙粉末加入到饱和NH4Cl溶液中,产生气体,粉末溶解,说明碳酸钙和比碳酸强的酸反应,只能是氯化铵水解生成的HCl,所以NH4Cl水解使溶液呈酸性,故A正确;
B.浓度商大于溶度积常数时产生沉淀,将BaSO4固体粉末加入饱和Na2CO3溶液中,搅拌,过滤,洗涤,在滤渣中加入稀盐酸,产生气体,滤渣部分溶解,说明有碳酸钡生成,碳酸根离子和钡离子浓度商大于碳酸钡溶度积,导致产生碳酸钡沉淀,实际上Ksp(BaCO3)>Ksp(BaSO4),故B错误;
C.加热条件下,Cu易与氧气反应生成CuO,所以生成的红色物质不可能是Cu和氧气,应该是氧化亚铜,故C错误;
D.HS-和HSO3-都能与HCl反应生成有刺激性气味的气体,所以该实验中不一定含有硫离子和亚硫酸根离子,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、氧化还原反应、沉淀的转化、盐类水解等知识点,明确实验原理及物质性质是解本题关键,注意检验离子时要排除其它离子的干扰,易错选项是B.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
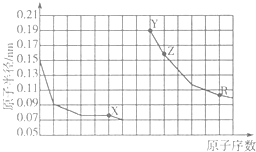
| A. | X、R的最简单氢化物的稳定性:X<R | |
| B. | X、Y、Z形成简单离子的半径大小:X>Y>Z | |
| C. | X、Y形成的化合物中只含有离子键 | |
| D. | Z单质着火可以用干冰进行灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜电极应与X相连接 | |
| B. | H+透过质子交换膜由左向右移动 | |
| C. | M电极反应式为CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25 mol气体时,则理论上铁电极增重32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下水的离子积常数为Kw,在该温度下,a mol•L-1一元酸HA与b mol•L-1一元碱BOH等体积混合,溶液呈中性,则溶液中c(H+)=$\sqrt{Kw}$ | |
| B. | 已知MgCO3的Ksp=6.82×10-6mol2•L-2,则在含有固体MgCO3的Na2CO3溶液中,有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| C. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度 | |
| D. | NH4Cl和NH3•H2O的混合溶液中,分别存在NH4+的水解平衡和NH3•H2O的电离平衡,二者对对方的平衡都起了促进作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
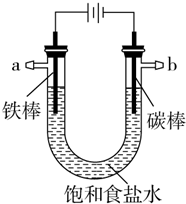 以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )
以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )| A. | 阳极电极反应式:Fe-3e-═Fe3+ | |
| B. | 水被电解后析出白色浑浊物为NaCl晶体 | |
| C. | 灰绿色浑浊是Fe(OH)2 | |
| D. | 随着电解的进行,溶液逐渐由中性变成碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
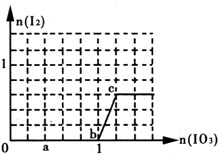
| A. | a点时消耗NaHSO3的物质的量为1.2 mol,得到的氧化产物为SO42- | |
| B. | b~c段的反应可用如下离子方程式表示:IO3-+5 I-+6H+═3I2+3H2O | |
| C. | 滴加过程中水的电离平衡一直逆向移动 | |
| D. | 从c点后所得混合液中分离出碘的操作为:加四氯化碳萃取分液,然后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
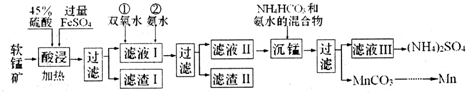
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
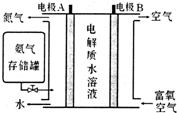
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度 | |
| B. | 加入CaCl2促进了HCO3-的电离 | |
| C. | 反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
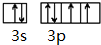 ,该元素的符号是S.
,该元素的符号是S.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com