
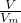 计算NO的物质的量,根据n=cV计算硝酸的物质的量,根据氮元素守恒可知n[Cu(NO3)2]=
计算NO的物质的量,根据n=cV计算硝酸的物质的量,根据氮元素守恒可知n[Cu(NO3)2]= [n(HNO3)-n(NO)],根据电子转移守恒有2n(Cu)+2n(Cu2O)=3n(NO),据此计算n(Cu2O),再根据铜元素守恒可知n(CuO)=n[Cu(NO3)2]-n(Cu)-2n(Cu2O),根据m=nM计算Cu2O与CuO的质量,进而计算二者质量比.
[n(HNO3)-n(NO)],根据电子转移守恒有2n(Cu)+2n(Cu2O)=3n(NO),据此计算n(Cu2O),再根据铜元素守恒可知n(CuO)=n[Cu(NO3)2]-n(Cu)-2n(Cu2O),根据m=nM计算Cu2O与CuO的质量,进而计算二者质量比.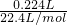 =0.01mol,
=0.01mol, [n(HNO3)-n(NO)]=
[n(HNO3)-n(NO)]= (0.1L×0.6mol/L-0.01mol)=0.025mol,
(0.1L×0.6mol/L-0.01mol)=0.025mol,

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源:2013届湖南省五市十校高三第一次联合检测化学试卷(带解析) 题型:填空题
(4分)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(标准状况)。则产物中硝酸铜的物质的量为 。如原混合物中有0.0lmolCu,则其中Cu2O与CuO的质量比为___________。
查看答案和解析>>
科目:高中化学 来源:2013届河北省容城中学高三上学期第三次月考化学试卷(带解析) 题型:计算题
(4分)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(标准状况)。则产物中硝酸铜的物质的量为________________。如原混合物中有0.0lmolCu,则其中Cu2O与CuO的质量比为___________。
查看答案和解析>>
科目:高中化学 来源:2013届湖南省岳阳市一中高三第一次质量检测化学试卷(带解析) 题型:计算题
硝酸是常见的三大强酸之一,在化学研究和化工生产中有着广泛应用,常用于制备硝酸盐、染料、肥料、医药中间体、烈性炸药等。硝酸盐多用于焰火、试剂、图像处理行业。
(1)某金属M的硝酸盐受热时按下式分解:2MNO3 2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为_____________。
2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为_____________。
(2)将32.64g铜与140mL 一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2L。其中NO的体积为_____________。
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(标准状况)。则产物中硝酸铜的物质的量为 。如原混合物中有0.0lmolCu,则其中Cu2O与CuO的质量比为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com