
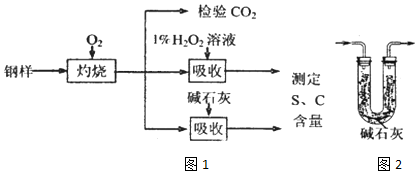
分析 (1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧,生成的固体产物中Fe、O两种元素的质量比为21:8,计算物质的量之比确定化学式;
(2)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧生成二氧化碳和二氧化硫,检验二氧化碳通过澄清石灰水检验,检查二氧化碳的存在需要除净二氧化硫;
(3)①过氧化氢氧化二氧化硫生成硫酸;
②将生成的气体用足量1%的H2O2溶液充分吸收,再用0.1000mol•L-1NaOH溶液滴定吸收液至终点,消耗NaOH溶液20.00mL,二氧化硫和氢氧化钠反应生成亚硫酸钠,硫元素守恒计算得到硫元素质量,另取10.00g钢样在足量氧气中充分灼烧,将生成的气体通过盛有足量碱石灰的U型管(如图2),键石灰增重0.614 g为二氧化碳和二氧化硫的质量,结合元素守恒计算;
③a.亚硫酸盐吸收了O2,生成二氧化硫减少;
b.碱石灰吸收了空气中的CO2,碳元素含量增大;
c.气体通过碱石灰的流速过快,末被充分吸收,导致质量减少;
解答 解:(1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧,生成的固体产物中Fe、O两种元素的质量比为21:8,n(Fe):n(O)=$\frac{21}{56}$:$\frac{8}{16}$=3:4,化学式为:Fe3O4,
故答案为:Fe3O4;
(2)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧生成二氧化碳和二氧化硫,检验二氧化碳通过澄清石灰水检验,检查二氧化碳的存在需要除净二氧化硫,所以先通过高锰酸钾溶液除去二氧化硫,再通过澄清石灰水检验二氧化碳,若变浑浊证明生成了二氧化碳,故选ab,
故答案为:ab;
(3)①二氧化硫被过氧化氢氧化生成硫酸,反应的离子方程式为:H2O2+SO2═2H++SO42-,
故答案为:H2O2+SO2═2H++SO42-;
②将生成的气体用足量1%的H2O2溶液充分吸收,再用0.1000mol•L-1NaOH溶液滴定吸收液至终点,消耗NaOH溶液20.00mL,二氧化硫和氢氧化钠反应生成亚硫酸钠,硫元素守恒计算得到硫元素质量,另取10.00g钢样在足量氧气中充分灼烧,将生成的气体通过盛有足量碱石灰的U型管(如图2),键石灰增重0.614 g为二氧化碳和二氧化硫的质量,结合元素守恒计算,
n(S)=n(SO2)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.02000L×0.1000mol•L-1=1.000×10-3mol;
w(S)=$\frac{1.000×1{0}^{-3}mol×32g/mol}{10.00g}$×100%=0.32%,
m(CO2)=0.614-m(SO2)=0.550g
n(C)=n(CO2)=$\frac{0.55g}{44g/mol}$=0.0125mol,
w(C)=$\frac{0.0125mol×12g/mol}{10.00g}$×100%=1.5%,
故答案为:n(S)=n(SO2)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.02000L×0.1000mol•L-1=1.000×10-3mol;
w(S)=$\frac{1.000×1{0}^{-3}mol×32g/mol}{10.00g}$×100%=0.32%,
m(CO2)=0.614-m(SO2)=0.550g
n(C)=n(CO2)=$\frac{0.55g}{44g/mol}$=0.0125mol,
w(C)=$\frac{0.0125mol×12g/mol}{10.00g}$×100%=1.5%;
③a.亚硫酸盐吸收了O2,生成二氧化硫减少,生成二氧化碳增大,测定结果偏高,故a正确;
b.碱石灰吸收了空气中的CO2,碳元素含量增大,测定碳元素含量增大,故b增大;
c.气体通过碱石灰的流速过快,末被充分吸收,导致质量减少,测定碳元素质量分数比真实值偏低,故c错误;
故答案为:ab.
点评 本题考查了物质组成、物质成分的实验测定、物质性质和盐酸组成的计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液的方法可以分离汽油和水 | |
| B. | 酒精灯加热试管时须垫石棉网 | |
| C. | NH3能使湿润的蓝色石蕊试纸变红 | |
| D. | 盛放NaOH溶液的广口瓶,可用玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用图表示. 下列关于海洋氮循环的说法正确的是( )
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用图表示. 下列关于海洋氮循环的说法正确的是( )| A. | 海洋中的氮循环起始于氮的氧化 | |
| B. | 海洋中的氮循环属于固氮作用的是③ | |
| C. | 海洋中的反硝化作用一定有氧气的参与 | |
| D. | 向海洋排放含NO3-的废水会影响海洋中NH4+的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅熔点高,可用作光导纤维 | |
| B. | 过氧化钠可与二氧化碳反应生成氧气,可用作呼吸供氧剂 | |
| C. | 明矾易溶于水,可用作净水剂 | |
| D. | 二氧化硫有氧化性,可用于漂白纸张 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2均能与盐酸反应生成NaCl,二者都是碱性氧化物 | |
| B. | Na2O2在空气中易变质,需要密封保存,Na2O性质稳定,不必密封保存 | |
| C. | 在呼吸面具中,Na2O2能做供氧剂,而Na2O不能 | |
| D. | 将Na2O2放入氢氧化钠溶液中,不发生反应,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量守恒原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L的CO气体1molN2所含的电子数也相等 | |
| B. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 标准情况下将2.24LCl2通入到2L水中,充分反应后转移的电子数且小于0.1NA | |
| D. | 300mL2mol•L-1蔗糖溶液中所含分子数为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com