
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用氯气.
I.工业上通常采用电解法制氯气:观察下图,回答:
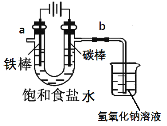
(1)电解反应的化学方程式为____________________。
(2)饱和食盐水通电后,b端产生的气体检验方法是____________。
II. 实验室用NaOH固体配制100 mL 1.0 mol·L-1的NaOH溶液,试回答下列各题:
(3)需要用托盘天平称量_______g NaOH固体;
(4)实验室有下列仪器:①漏斗 ②200mL容量瓶 ③烧杯 ④玻璃棒 ⑤药匙 ⑥托盘天平 ⑦冷凝。若要实施溶液配制,尚缺的玻璃仪器是___________、________;
(5)容量瓶在使用前必须先____________;
(6)配制过程有以下操作: ①称量 ②移液 ③冷却 ④洗涤 ⑤定容 ⑥溶解 ⑦摇匀 其正确的操作顺序应是:① →_________→________ →________ →________→________→ ⑦
(7)下列五项操作中会导致所得溶液浓度偏低的有____________(填序号);
①没有洗涤烧杯内壁和玻璃棒
②未冷却到室温就将溶液转移到容量瓶并定容
③在转移过程中有溶液撒在外面
④定容时观察液面时俯视
⑤定容后,把容量瓶反复摇匀后发现液面低于刻度线,便滴加几滴水至刻度处
【答案】2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口出,若试纸变蓝,则说明产生的气体为Cl2 4.0 100mL容量瓶 胶头滴管 检查容量瓶是否完好以及瓶塞处是否漏水或检漏 ⑥ ③ ② ④ ⑤ ①③⑤
2NaOH+H2↑+Cl2↑ 移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口出,若试纸变蓝,则说明产生的气体为Cl2 4.0 100mL容量瓶 胶头滴管 检查容量瓶是否完好以及瓶塞处是否漏水或检漏 ⑥ ③ ② ④ ⑤ ①③⑤
【解析】
(1)在工业上用电解饱和食盐水的方法制取氯气;
(2)电解时与电源正极连接的电极为阳极,阳极发生氧化反应,与电源负极连接的电极为阴极,阴极发生还原反应。根据Cl2与KI发生置换反应,I2遇淀粉溶液变为蓝色检验Cl2。
(3)根据n=c·V及m=n·M计算NaOH的质量;
(4)依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
(5)根据容量瓶的作用及溶液特点分析;
(6)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,据此排序;
(7)分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 进行误差分析。
进行误差分析。
I.(1)电解饱和食盐水的方法制取氯气,反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(2)根据图示可知,b端连接电源的正极,为阳极,在阳极,溶液中的阴离子放电。由于阴离子的放电能力Cl->OH-,所以b端发生反应2Cl--2e-=Cl2↑;b端产生的气体是Cl2,该物质具有强的氧化性,与KI在溶液中发生反应:Cl2+2KI=2KCl+I2,I2遇淀粉溶液变为蓝色,所以检验Cl2方法是移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口处,若试纸变蓝,则说明产生的气体为Cl2。
(3)要配制100 mL 1.0 mol/L的NaOH溶液,根据n=c·V可知:n(NaOH)=1.0mol/L×0.1L=0.1mol,则需要称量NaOH的质量m=n·M=0.1mol×40g/mol=4.0g;
(4)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,需要使用的仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、一定规格的容量瓶、胶头滴管,配制100mL1.0mol/L的NaOH溶液,应选择100mL容量瓶,所以还缺少的仪器:100mL容量瓶、胶头滴管;
(5)容量瓶是准确配制一定体积一定物质的量浓度溶液的仪器,由于溶液检验均一性,溶液各处的浓度相同,在配制溶液时要摇匀溶液,所以在使用前必须先检查容量瓶是否完好以及瓶塞处是否漏水或检漏;
(6)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以其正确的操作顺序应是①⑥③②④⑤⑦;
(7)①没有洗涤烧杯内壁和玻璃棒,使溶质的质量减少,n减小,则c偏低,①符合题意;
②未冷却到室温就将溶液转移到容量瓶并定容,等溶液恢复至室温后,液面低于刻度线,V偏小,则溶液浓度偏高,②不符合题意;
③在转移过程中有溶液撒在外面,使n偏少,则导致配制的溶液浓度偏低,③符合题意;
④定容时观察液面时俯视,则V偏小,使物质的量浓度偏高,④不符合题意;
⑤定容后,把容量瓶反复摇匀后发现液面低于刻度线,便滴加几滴水至刻度处,对溶液进行了稀释,使溶液浓度偏低,⑤符合题意;
故正确选项是①③⑤。


科目:高中化学 来源: 题型:
【题目】常温下,Ka(CH3COOH)=1.75×10-5, Ka (HCN)=6.2×10-10,下列说法正确的是
A. 0.1mol/L CH3COONa溶液与0.1mol/L KCN溶液:c(Na+)-c(CH3COO-)> c(K+)-c(CN-)
B. 20mL0.1 mol/L CH3COONa与10mL 0.1 mol/L HCl溶液混合后所得酸性溶液:c(Na+)>c(CH3COOH)>c(CH3COO-)
C. 0.2 mol/LHCN溶液与0.1 mol/L NaOH溶液等体积混合所得溶液:c(Na+)>c(CN-)>c(OH-)>c(H+)
D. 向浓度均为0.1mol/L的CH3COOH和HCN混合溶液中滴加0.1mol/LNaOH溶液,当恰好中和时所得溶液: c(CH3COOH)+c(HCN)+c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的( )
A. 实验室用固体氯化铵和熟石灰共热制取NH3:2NH4++Ca(OH)2![]() 2NH3↑+ Ca2++2H2O
2NH3↑+ Ca2++2H2O
B. 铜与浓硝酸反应: 3Cu + 8H+ + 2NO3- =3Cu2+ + 2NO↑ + 4H2O
C. 氨水与FeCl3反应:3OH- + Fe3+ =Fe(OH)3↓
D. 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O===2HCO![]() +SO32-
+SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将燃煤排放的含有SO2的烟气通入海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子)进行脱硫的工艺流程如图所示,下列说法中正确的是( )
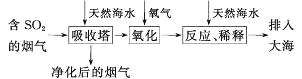
A. 天然海水显酸性
B. 氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42-
C. 排入大海的溶液与天然海水相比,只有SO42-数量发生了变化
D. 若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素质量的关系曲线,如图2所示。则下列分析正确的是( )
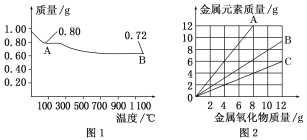
A. 图1中,A到B的过程中有0.005 mol电子发生了转移
B. 图1整个过程中共生成0.18 g水
C. 图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D. 图1中A和B化学式分别为Cu2O和CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】17.4g MnO2与240 mL 10 mol/L(密度为1.10g/mL)的盐酸(足量)混合加热(不考虑盐酸挥发),使其充分反应后,再向溶液中加入足量的AgNO3溶液。(已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
试求:(1)10 mol/L的盐酸的质量分数____________
(2)产生的气体在标准状况下的体积______________;
(3)产生沉淀的质量_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
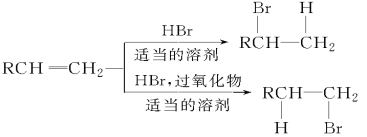
A、B、C、D、E有如下转化关系:

其中A、B是分子式均为C3H7Br的两种同分异构体。根据图中各物质的转化关系,填写下列空白:
(1)写出下列物质的结构简式:B___________、C________________;
(2)完成下列反应的化学方程式及反应类型
①A―→E__________________________________________;____。
②B―→D _________________________________________; ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是_______,其价电子排布式为______。
(2)第四电离能大小:I4(Fe)> I4(Co),从原子结构的角度分析可能的原因是____。
(3)取1mol配合物CoCl3·6NH3(黄色)溶于水,加入足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为_______。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式_____;生成气体分子的中心原子杂化方式为____。
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于_____,若该堆积方式下钴原子的半径为r,则该晶体的空间利用率为______(列出表达式并写出最终结果)。
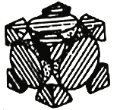
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图所示是组成人体细胞的主要元素及其比例,下列叙述错误的是

A.图中所示为细胞鲜重中元素的比重
B.图中含有的元素在非生物界也可以找到
C.细胞失去大部分水分后,碳元素比例最大
D.因为氧元素含量最多,所以氧是“生命的核心元素”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com