
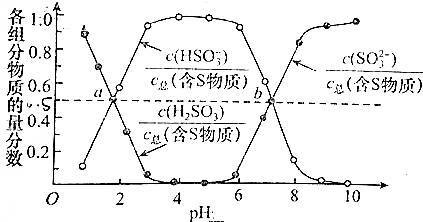
分析 根据图象曲线在二者比值的变化及亚硫酸铵、亚硫酸氢铵的化学式组成进行分析、计算.
解答 解:“亚硫酸铵吸收法”用(NH4)2SO3溶液在吸收塔中封闭循环脱轨,发生的主要反应为(NH4)2SO3+SO2+H2O=2NH4HSO3,测得25℃时溶液pH与各组分物质的量分数的变化关系如图1所示,根据图象可知a点时两个比值相等,则n(HSO3-):n(H2SO3)=1:1;
b点时溶液pH=7,根据电荷守恒可知n(NH4+)=n(HSO3-)+2n(SO32-),
又根据图象曲线可知,n(HSO3-)=n(SO32-),则n(NH4+):n(HSO3-)=(1+2):1=3:1,
故答案为:1:1;3:1.
点评 本题考查了图象分析题,题目难度中等,侧重于考查分析能力和计算能力,注意把握图象中各条曲线的含义以及溶液中电荷守恒的应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
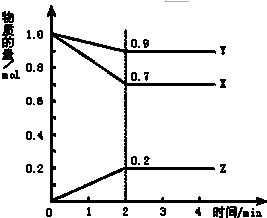 某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,反应开始至2min时:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,反应开始至2min时:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+H2S=NaHCO3+NaHS | B. | Na2S+H2O+CO2=NaHS+NaHCO3 | ||
| C. | 2NaHCO3+H2S=Na2S+2H2O+2CO2 | D. | NaHS+H20+CO2=NaHCO3+H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L的盐酸 | B. | 0.01mol/L的醋酸溶液 | ||
| C. | c(H+)=10-3mol/L的溶液 | D. | c(OH-)=10-1mol/L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依原电池的原理设计出化学电源 | |
| B. | 原电池是化学电源的雏形 | |
| C. | 原电池输出电能的能力取决于组成原电池的负极材料的活泼性 | |
| D. | 氧化还原反应所释放出的化学能是化学电池的能量来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
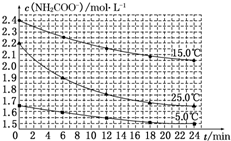 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
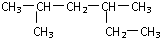 的名称是2,4-二甲基己烷
的名称是2,4-二甲基己烷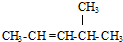 的名称是2-甲基-2-戊烯
的名称是2-甲基-2-戊烯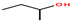
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com