
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
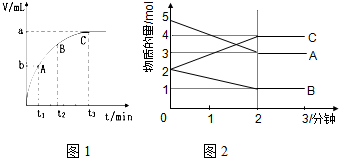
分析 Ⅰ.(1)二氧化锰是过氧化氢分解的催化剂,由带火星木条复燃,可知产物,由此可写出方程式;
(2)由实验现象可知催化剂作用大小的影响因素;
(3)从原点与A、B、C画出三点射线,射线的斜率代表反应速率,斜率越大,反应速率越大;
Ⅱ.(4)从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(5)化学反应速率是单位时间内浓度的变化,据此可求得反应速率;
(6)可逆反应达到平衡状态时,正逆反应速率相等,各组分浓度不再变化,若存在有色物质,则有色物质的颜色也不再变化,据此对各选项进行判断;
(7)根据A达到平衡时已转化的物质的量与起始的物质的量之比,可求得平衡时A的转化率.
解答 解:Ⅰ.(1)H2O2在二氧化锰作用下发生反应的化学反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)因在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明催化剂的颗粒大小对反应速率有影响,
故答案为:催化剂的颗粒大小;
(3)该图象横坐标表示时间,纵坐标表示生成气体的体积,从原点与A、B、C画出三点射线,射线的斜率代表反应速率,斜率越大,反应速率越大,根据图象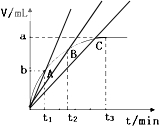 可知,斜率最大的为A,斜率最小的为C,所以即时反应速率最慢的为C,
可知,斜率最大的为A,斜率最小的为C,所以即时反应速率最慢的为C,
故答案为:C;
Ⅱ.(4)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B?2C,
故答案为:2A+B?2C;
(5)由图象可以看出,反应开始至2分钟时,△n(B)=1mol,B的平均反应速率为:$\frac{\frac{1mol}{5L}}{2min}$=0.1mol/(L•min),
故答案为:0.1mol/(L•min);
(6)a.v(A)=2v(B)不能说明正反应和逆反应的关系,故无法判断反应是否达到平衡,故a错误;
b.容器内各物质的物质的量相等,不能说明各组分的浓度不再变化,无法判断是否达到平衡状态,故b错误;
c.在该反应中A和C的计量数相等,当v逆(A)=v正(C)时,正逆反应速率相等,说明反应已达平衡状态了,故c正确;
d.只有A为有色物质,当容器内气体的颜色保持不变,说明各组分的浓度不再变化,该反应已经达到平衡状态,故d正确;
故答案为:cd;
(7)由图象可知:达平衡时A的浓度变化为:△n(A)=5mol-3mol=2mol,
所以A的转化率为:$\frac{2mol}{5mol}$×100%=40%,
故答案为:40%.
点评 本题考查影响化学反应速率因素及化学平衡图象的计算,题目难度中等,注意把握由图象判断化学方程式的方法以及反应现象与结论的推断,试题侧重考查学生的分析能力及化学计算、化学实验能力.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 木炭在氧气中燃烧 | B. | 铁粉与高温水蒸气反应 | ||
| C. | 碳酸氢铵受热分解 | D. | Na2O2加入氯化铵溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10m | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | 元素③与⑧的金属性相比:前者强于后者 | |
| B. | 上述8种元素中,元素⑤的最高价氧化物对应的水化物酸性最强 | |
| C. | 元素⑦的气态氢化物与元素④的气态氢化物相比较:前者稳定性强,后者沸点高 | |
| D. | 元素①分别与元素②和⑥形成的化合物所含化学键类型不一定完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极是Ag2O,负极是Zn | |
| B. | 该电池负极的电极反应式为:Zn+2OH--2e-═ZnO+H2O | |
| C. | 理论上该电池工作一段时间后,溶液中KOH的浓度不变 | |
| D. | 该电池工作时,电解质中的阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A、探究不同催化剂对同一反应速率的影响 | B、探究温度对化学平衡的影响 |
 试剂:淀粉溶液、碘水、 唾液、2mol/L H2SO4溶液 现象:图中左试管溶液颜色一段时间后逐渐变蓝色,右试管溶液颜色迅速变蓝色 | 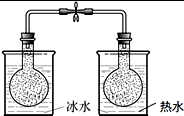 2NO2(g)?N2O4△H<0 试剂:烧瓶中各充入等质量的NO2 现象:一段时间后,右边烧瓶内气体颜色变浅,左边烧瓶内气体颜色变深 |
| C、探究醋酸、碳酸、硼酸的酸性强弱 | D、验证外加电流的阴极保护法 |
 试剂:0.1mol/L醋酸溶液、饱和硼酸 溶液0.1mol/L Na2CO3溶液 现象:图中左试管内液面产生气泡,右试管无明显现象 | 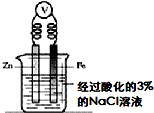 试剂:酸化的3%的NaCl溶液、 铁氰化钾溶液 现象:一段时间后,向烧杯中滴加2滴铁氰化钾溶液,不产生蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com