
以下各组粒子不能互称为等电子体的是( )
A. CO和N2 B. N2H4 和C2H4 C. O3和SO2 D. CO2和N2O
考点: “等电子原理”的应用.
专题: 原子组成与结构专题.
分析: 根据等电子体概念分析,等电子原理:具有相同原子数和价电子数的微粒互称为等电子体.
解答: 解:A.CO和N2的原子个数都为2;价电子数:前者碳为4,氧为6,共为10,后者氮为5,共为10,原子数相等,价电子数相等,属于等电子体,故A正确;
B.N2H4 和C2H4的原子个数都为6;价电子数:前者氮为5,氢为1,共为14,后者碳为4,氢为1,共为12,原子数相等,但价电子数不相等,不属于等电子体,故B错误;
C.O3和SO2的原子个数都为3;价电子数:前者氧为6,共为18,后者硫和氧都为6,共为18,原子数和价电子数都相等,属于等电子体,故C正确;
D.CO2和N2O的原子个数都为3;价电子数:前者碳为4,氧为6,共为16;后者氮为5,氧为6,共为16,原子数和价电子数都相等,属于等电子体,故D正确;
故选B.
点评: 本题考查了等电子体,解答本题关键是充分理解等电子体的本质特征,难度中等.


科目:高中化学 来源: 题型:
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g),此反应达到平衡的标志是()
A. 容器内压强不随时间变化
B. v正(X)=v逆(Z)
C. 容器内X、Y、Z的浓度之比为1:2:2
D. 单位时间消耗0.1molX同时生成0.2molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
对于2SO2(g)+O2(g)⇌2SO3(g)△H<0 反应来说:
(1)若将2mol SO2气体和1mol O2气体在2L容器中混合并在一定条件下发生反应,经2min建立平衡,此时测得SO3浓度为0.8mol•L﹣1,则从开始至2min用氧气表示的平均速率v(O2)= ;该条件时反应的平衡常数K= .
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有 (填字母).
A.升高温度B.降低温度C.增大压强 D.移出生成的SO3
(3)一定温度下,若将8mol SO2气体和4mol O2气体混合置于体积恒定的密闭容器中,能说明该反应已达到平衡状态的是 .
A.SO2的转化率和O2的转化率相等 B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正 D.容器内密度保持不变
(4)一定温度下,将8mol SO2和4mol O2气体混合置于体积不变的密闭容器中,经t1时间达到平衡,测得混合气体总物质的量为10mol.若此时向容器中充入一定量的氦气,SO3(g)的物质的量将不变(填“增大”、“减小”或“不变”);若使SO2、O2、SO3三种气体均增加1mol,则平衡 (填“向左移动”、“向右移动”或“不移动”).
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物X催化氧化的产物是(CH3)2CHCHO,有机物X是( )
A. 乙醇的同系物 B. 乙醛的同系物
C. 丙醇的同分异构体 D. 丙醛的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:则符合上述条件的酯的结构可能有( )
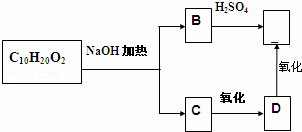
A. 2种 B. 8种 C. 6种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
硼和镁形成的化合物刷新了金属化合物超导温度的最高记录.如图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下面还各有一个镁原子;6个硼原子位于棱柱的侧棱上,则该化合物的化学式可表示为( )
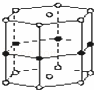
A. MgB B. Mg3B2 C. MgB2 D. Mg2B3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知两个热化学方程式:
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol.
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是()
A. 1:1 B. 1:2 C. 2:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
废水、废气、废渣的处理是减少污染、保护环境的重要措施。
(1)烟气中的NOx必须脱除(即脱硝)后才能排放。
①列举一种由NOx引起的大气污染现象: 。
②已知:CH4 (g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)=2NO(g);ΔH=+180 kJ·mol-1
则CH4脱硝的热化学方程式为CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l),ΔH=_____。
③下图是一种用NH3脱除烟气中NO的原理。该脱硝反应中,氧化剂是 ;
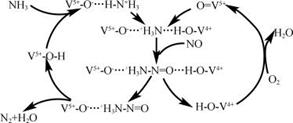
(2) 下图是一种三室微生物燃料电池污水净化系统原理示意图,同时处理有机废水和硝酸盐废水,并获得淡水。图中有机废水中有机物可用C6H10O5表示。
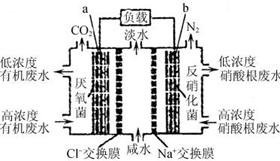
①电池正极为 。(填“a”或“b”)
②电极a上的电极反应式为 。
③电池工作过程中Na+离子移向 、Cl-离子移向 。(填“a电极”、或“b电极”)
④假设咸水中氯化钠的质量分数为2.34%,当两极总共产生7.84 L气体(标准状况下)时,理论上处理咸水 g。(忽略CO2的溶解)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com