
| A. | 原子半径:丁>丙>乙 | |
| B. | 单质的还原性:丁>丙 | |
| C. | 甲、乙、丙的氧化物均为共价化合物 | |
| D. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
分析 短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,化合物为氨气,则甲为H,乙位于第ⅤA族,乙为N,甲与丙同主族,结合原子序数可知丙为Na,丁原子最外层电子数与电子层数相等,丁为第三周期ⅢA族,为Al,以此来解答.
解答 解:由上述分析可知,甲、乙、丙、丁分别为H、N、Na、Al,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:丙>丁>乙,故A错误;
B.同周期从左向右金属性减弱,则单质的还原性:丁<丙,故B错误;
C.甲的氧化物为共价化合物,而乙、丙的氧化物为离子化合物,故C错误;
D.乙、丙、丁的最高价氧化物对应的水化物分别为硝酸、NaOH、氢氧化铝,而氢氧化铝具有两性,能相互反应,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、元素化合物知识、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝反应放出H2的溶液Na+、NH4+、Cl?、NO3- | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42-、I? | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl?、HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
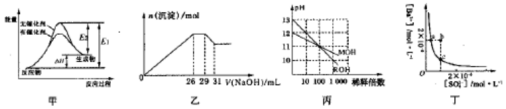
| A. | 若图甲表示某可逆反应的能量变化,说明催化剂能改变正、逆反应的活化能 | |
| B. | 图乙表示在含Mg2+、A13+、NH4+、Cl-的溶液中,加入一定浓度NaOH溶液时生成沉淀的图象,由图可得原溶液中n(Mg2+):n(Al3+):n(NH4+)=10:2:3 | |
| C. | 图丙表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH | |
| D. | 图丁表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶 液由a点变到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 室温下,该HA的电离平衡常数约为10-5 | |
| B. | C点时加入NaOH溶液的体积为10mL | |
| C. | 滴定过程中从A到D点溶液中水的电离程度先增大后减小 | |
| D. | 若B点加入的NaOH溶液体积为5mL,所得溶液中c(A-)+2c(OH-)═c(HA)+2 c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知有H、C、N、O、Na、Si、Cl、Ca、Fe等元素,请回答下列问题:
已知有H、C、N、O、Na、Si、Cl、Ca、Fe等元素,请回答下列问题: (写出一种即可).
(写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl-、Mg2+、H+、Zn2+、SO42- | B. | Na+、Ba2+、NO3-、OH-、SO42- | ||
| C. | K+、NO3-、SO42-、OH-、Na+ | D. | MnO4-、K+、Cl-、H+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com