
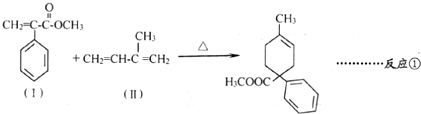
 .
.  .
.  .
. 和其他无机物叫合成
和其他无机物叫合成 ,最合理的方案
,最合理的方案 $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$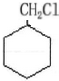 $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$ $\stackrel{Cl_{2}}{→}$
$\stackrel{Cl_{2}}{→}$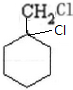
 .
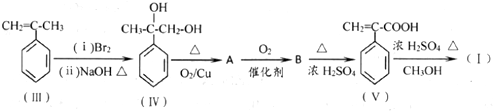
. 分析 III先和溴发生加成反应生成溴代烷,溴代烷再和NaOH的水溶液加热发生取代反应生成IV,IV发生氧化反应生成A,A结构简式为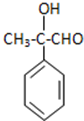 ,A发生氧化反应生成B,B结构简式为
,A发生氧化反应生成B,B结构简式为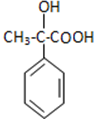 ,B发生消去反应生成V,V和甲醇在浓硫酸作催化剂、加热条件下发生酯化反应生成I,
,B发生消去反应生成V,V和甲醇在浓硫酸作催化剂、加热条件下发生酯化反应生成I,
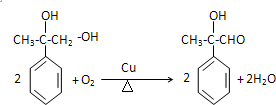
(1)(Ⅳ)在Cu作催化剂、加热条件下发生氧化反应生成A;
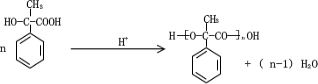
(2)酸性条件下,化合物B能发生聚合反应生成高分子化合物;
(3)(Ⅲ)与(Ⅱ)也能发生类似反应①的反应,生成含两个六元环的化合物的结构简式为 ;
;
(4)在催化剂条件下, 和氢气发生加成反应生成
和氢气发生加成反应生成 ,
, 和氢氧化钠的醇溶液加热发生消去反应生成
和氢氧化钠的醇溶液加热发生消去反应生成 ,
, 和Cl2发生加成反应生成
和Cl2发生加成反应生成 ,
, 和NaOH的水溶液加热发生取代反应生成
和NaOH的水溶液加热发生取代反应生成 .
.
解答 解:III先和溴发生加成反应生成溴代烷,溴代烷再和NaOH的水溶液加热发生取代反应生成IV,IV发生氧化反应生成A,A结构简式为 ,A发生氧化反应生成B,B结构简式为
,A发生氧化反应生成B,B结构简式为 ,B发生消去反应生成V,V和甲醇在浓硫酸作催化剂、加热条件下发生酯化反应生成I,
,B发生消去反应生成V,V和甲醇在浓硫酸作催化剂、加热条件下发生酯化反应生成I,
(1)(Ⅳ)在Cu作催化剂、加热条件下发生氧化反应生成A,反应方程式为 ,
,
故答案为: ;
;
(2)酸性条件下,化合物B能发生聚合反应生成高分子化合物,反应方程式为 ,
,
故答案为: ;
;
(3)(Ⅲ)与(Ⅱ)也能发生类似反应①的反应,生成含两个六元环的化合物的结构简式为 ,故答案为:
,故答案为: ;
;
(4)在催化剂条件下, 和氢气发生加成反应生成
和氢气发生加成反应生成 ,
, 和氢氧化钠的醇溶液加热发生消去反应生成
和氢氧化钠的醇溶液加热发生消去反应生成 ,
, 和Cl2发生加成反应生成
和Cl2发生加成反应生成 ,
, 和NaOH的水溶液加热发生取代反应生成
和NaOH的水溶液加热发生取代反应生成 ,其流程图为:
,其流程图为: $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$ $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$ $\stackrel{Cl_{2}}{→}$
$\stackrel{Cl_{2}}{→}$ $→_{△}^{NaOH的水溶液}$
$→_{△}^{NaOH的水溶液}$ ,
,
故答案为: $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$ $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$ $\stackrel{Cl_{2}}{→}$
$\stackrel{Cl_{2}}{→}$ $→_{△}^{NaOH的水溶液}$
$→_{△}^{NaOH的水溶液}$ .
.
点评 本题考查有机合成,为高频考点,涉及合成路线的设计、有机物的推断等知识点,综合性较强,根据反应条件、分子式、结构简式进行推断,难点是(4)题合成路线设计,要求学生熟练掌握常见有机反应类型、反应条件、有机物结构和性质,题目难度中等.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
有关乙烯的下列叙述:① 乙烯溶于水后可得乙醇;② 乙烯能发生加聚反应;③ 乙烯能与溴水发生加成反应;④ 乙烯是无色、稍有气味、难溶于水的气体;其中正确的是( )
A.全部 B.①和③ C.②和③ D.②③④
查看答案和解析>>
科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:选择题
《神农本草经》说:“水银-镕化(加热)还复为丹”。《黄帝九鼎神丹经》中的“柔丹”“伏丹”都是在土釜中加热Hg制得的,这里的“丹”是指
A.氯化物
B.合金
C.硫化物
D.氧化物
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0、△S<0
B.使用催化剂能够降低化学反应的反应热(△H)
C.由Ka(HCN)<Ka(CH3COOH)可说明在相同条件下,氢氰酸的酸性比醋酸弱
D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
化学已渗透到人类生活的各个方面,下列说法的错误是
A.交警检查司机是否酒后驾车的原理中体现了乙醇的还原性
B.14C可用于文物年代的鉴定,14C与12C互为同位素
C.铜的金属活动性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
D.以石油、煤和天然气为原料通过聚合反应可以获得用途广泛的高分子合成材料
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
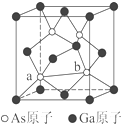 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
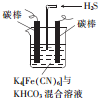 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液的体积10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 | |
| C. | 若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com