
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | 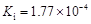 |  | 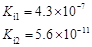 | 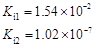 |
 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O ,试配平上述化学方程式。
,试配平上述化学方程式。 (1)Ki值越大,酸性越强 (2分,合理给分)
(2)BD (2分)
(3)C(HCOO—)>C(Na+)>C(H+)>C(OH—) (2分)
(4)H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4 (2分)
(5)C (2分)
(6)8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O (2分)
解析试题分析:(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为.Ki值越大,表示电离出氢离子的程度越大,则酸性越强。
(2)根据电离平衡常数可知A正确的是ClO- + H2O + CO2 → HClO + HCO3-,错误。B正确。C.H2SO3 + HCOO- → HCOOH + HSO3- ,错误。D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-,正确。
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,生成HCOONa,由于甲酸是弱酸相当于有剩余,故混和液呈酸性,HCOOH电离程度大于甲酸根的水解程度,故溶液中离子浓度由大到小的顺序为C(HCOO—)>C(Na+)>C(H+)>C(OH—)。
(4)由信息:亚硒酸(H2SeO3)有较强的氧化性。SO2具有还原性,会产生红褐色单质应该是硒单质,则该反应的化学方程式:H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),此时过氧化氢做氧化剂,则H2SeO4既是氧化产物又是还原产物。
(6)根据化合价升降法和题目中的信息:TeO2与Te的物质的量之比为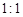 ,配平方程式为8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O。
,配平方程式为8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O。
考点:本题考查了电离平衡常数的运用和盐类水解原理判断离子浓度的大小关系以及氧化还原方程式的配平技巧。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
金属冶炼与处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是________。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是________。当1 mol O2发生反应时,还原剂所失电子的物质的量为________mol。向CuSO4溶液中加入镁条时有气体生成,该气体是________。
(3)如图为电解精炼银的示意图,________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为__________________________。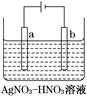
(4)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol·L -1HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。(已知:Cu2O+2H+=Cu+Cu2++H2O)
(1)Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物
质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分) 实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
(1)在该反应中,还原剂是 。
(2)若在反应中生成了标况下2.24L氯气,则电子转移的个数是 NA。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
许多物质的氧化能力受溶液酸碱性的影响。高锰酸钾在不同的条件下发生的还原反应如下:
MnO4—+ 5e + 8H+ → Mn2+ + 4H2O
MnO4— + 3e + 2H2O → MnO2 + 4OH—
MnO4— + e → MnO42—(溶液呈绿色)
MnO2的还原反应可表示如下:MnO2+4H+ + 2e → Mn2++2H2O
(1)MnO2与稀盐酸不能制取氯气,其原因是 。
(2)将SO2通入KMnO4溶液中,发生还原反应的过程为______→_______
(用化学式或离子符号表示)。
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列叙述正确的是________(选填编号)。
a.氧化性:PbO2>KMnO4 b.还原性:PbO2> KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾溶液逐滴加入到硫化钾溶液中可发生如下反应,其中K2SO4和S的物质的量之比为3:2。完成并配平该反应的化学方程式。
___KMnO4+___K2S+___ _____ → ___K2MnO4 +___K2SO4 +__S↓+___ ___
反应若生成5.44 g单质硫,反应过程中转移电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究物质间的氧化还原反应有重要的意义。
(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是___________;生成0.5molK2FeO4转移电子的物质的量____________mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O
放电时,电池的负极反应式为____________。充电时电解液的pH____________(填“增大”“不变”或“减小”)
(3)H2O2是一种绿色氧化剂。工业制备H2O2的原理如下:
①电解池总反应:2S2O42?+2H+═S2O82-+H2↑
②电解生成的S2O82-水解:S2O82-+2H2O═H2O2+2H++SO42?
电解池中阴极反应式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(配平)来制取单质I2。NaIO3来源于自然界的矿物。
① NaIO3 + NaHSO3— NaI + Na2SO4 + H2SO4 ② IO3-+I-+H+—I2+H2O
(1)配平上述反应
(2)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。请计算开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是多少?
(3)25℃时,H2SO3 HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液, 的值 ;加入少量水,水的电离程度将 。
的值 ;加入少量水,水的电离程度将 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.某溶液中仅含下表离予中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均相等都为0.0lmol。
①若向原溶液中加入KSCN溶液,无明显变化。
②若向原溶液中加入过量的盐酸,有气体生成.溶液中阴离子种类不变。
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
试回答下列问题
(1)若先向原溶液中先加入过量的盐酸,再加入KSCN溶液,现象是__________________。该过程中涉及的离子方程式有________________、__________________。
(2)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体为____________________(写化学式)。
(3)向原溶液中加入足量盐酸后,用排水法收集所产生的气体并使气体恰好充满容器,将容器倒置于水槽中,再向容器中通入___________mLO2(气体体积均指标准状况),能使溶液充满该容器。
Ⅱ.amolCu2S和bmol FeS投入到v L c mol/L的稀硝酸中;充分反应,生成NO气体,所得澄清溶液可以看作Cu(NO3)2、Fe(NO3)3和H2SO4的混合溶液,则反应中未被还原的硝酸的物质的量为 ___________mol(用同时含有a、b、v、c的表达式表示)。
Ⅲ.已知CH4(g)+2O2(g) CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g)
CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
据此计算出△H2=_____________kJ/mol(用含a和b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列变化中起氧化作用和还原作用的元素不是同一种元素的是( )
| A.在400 ℃左右且有催化剂存在的条件下,用氨气把一氧化氮还原为氮气 |
| B.工业上用稀硫酸和氧气与单质铜反应制取硫酸铜 |
| C.工业上用石灰乳和氯气制备漂白粉 |
| D.实验室用氯酸钾和浓盐酸制取氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com