
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)()
A. 阳极发生还原反应,其电极反应式:Ni2++2e﹣═Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
考点: 电解原理.
专题: 电化学专题.
分析: A、阳极失去电子发生氧化反应;
B、阳极失电子的有Fe、Zn、Ni;阴极析出的是镍;依据电子守恒计算分析;
C、精炼过程中,电解质溶液中一定含有Ni2+;
D、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和鉑不失电子沉降电解池底部形成阳极泥;
解答: 解:A、阳极发生氧化反应,其电极反应式:Ni﹣2e﹣=Ni2+,Fe﹣2e﹣=Fe2+;Zn﹣2e﹣=Zn2+;故A错误;
B、电解过程中阳极失电子的有Fe、Zn、Ni;阴极析出的是镍;依据电子守恒,阳极质量的减少 与阴极质量的增加不相等,故B错误;
与阴极质量的增加不相等,故B错误;
C、电解后,溶 液中存在的金属阳离子有Fe2+、Zn2+、Ni2+;故C错误;
液中存在的金属阳离子有Fe2+、Zn2+、Ni2+;故C错误;
D、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和鉑不失电子沉降电解池底部形成阳极泥,电解后,电解槽底部的阳极泥中只有Cu和Pt,故D正确;
故选D.
点评: 本题考查了电极原理的应用,主要考查电解精炼镍的原理分析判断.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
等质量的两份锌粉a、b分别加入到两份质量相同的过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是()
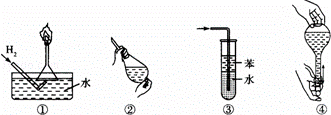
A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应过程能量变化如图所示,下列说法正确的是()
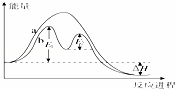
A. 反应过程a有催化剂参与
B. 该反应为放热反应,热效应不等于△H
C. 改变催化剂,可改变该反应的活化能
D. 有催化剂条件下,反应的活化能等于E1+E2
查看答案和解析>>
科目:高中化学 来源: 题型:
CO(g)+H2O(g)⇌H2(g)+CO2(g)△H<0,在其他条件不变的情况下()
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
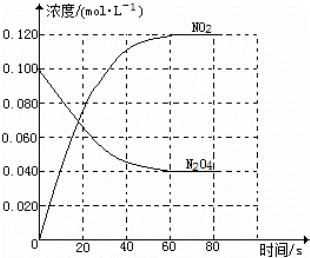
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度的升高,混合气体的颜色变深.
回答下列问题:
(1)反应的△H 0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为 mol•L﹣1•s﹣1;反应的平衡常数K1为 .
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L﹣1•s﹣1的平均速率降低,经10s又达到平衡.
①T 100℃(填“大于”或“小于”),判断理由是 .
②列式计算温度T时反应的平衡常数K2 .
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
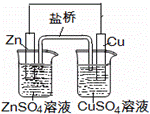
A. 电镀时,通常把待镀的金属制品作阴极
B. 氢氧燃料电池(酸性电解质)中O2通入负极
C. 图中电子由Cu极流向Zn,盐桥中的Cl﹣移向CuSO4溶液
D. 在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
U﹣235原子的裂变是目前人类利用核能的主要来源,下列有关 的说法正确的是( )
的说法正确的是( )
|
| A. |
|
|
| B. |
|
|
| C. |
|
|
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是()
A. HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反映的中和热△H=2×(﹣57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 甲烷的燃烧热就是1mol甲烷燃烧生成气态水和二氧化碳所放出的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com