
| A. | 乙烯与水反应制乙醇、乙醇与氧气反应制乙醛都属于加成反应 | |
| B. | 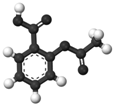 图为阿司匹林的球棍模型,其分子式是C9H8O4 | |
| C. | CH≡CH通过加聚反应可以得到结构片段为“…-CH=CH-CH=CH-…”的高分子化合物 | |
| D. | 往蛋白质溶液中加入饱和(NH4)2SO4溶液、CuSO4溶液都能产生沉淀,其原理不相同 |
分析 A.乙烯中含碳碳双键,与水发生加成反应;乙醇与氧气发生氧化反应生成乙醛;
B.由模型可知,含苯环、-COOH、-COOOCCH3;
C.CH≡CH通过加聚反应生成聚乙烯;
D.加入饱和(NH4)2SO4溶液、CuSO4溶液分别发生盐析、变性.
解答 解:A.乙烯中含碳碳双键,与水发生加成反应;乙醇与氧气发生氧化反应生成乙醛,则反应类型不同,故A错误;
B.由模型可知,含苯环、-COOH、-COOOCCH3,则其分子式是C9H8O4,故B正确;
C.CH≡CH通过加聚反应生成聚乙烯,则结构片段为“…-CH=CH-CH=CH-…”,故C正确;
D.加入饱和(NH4)2SO4溶液、CuSO4溶液分别发生盐析、变性,都能产生沉淀,其原理不相同,故D正确;
故选A.
点评 本题考查有机物的结构与性质,为高考常见题型,侧重于考查学生的分析能力和应用能力,注意把握官能团与性质的关系、有机反应为解答的关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | 碳酸钙溶于醋酸CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=8的氢氧化钠溶液1mL与999mL水混合 | |
| B. | pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合 | |
| C. | pH=2的盐酸与0.01mol/L的氨水等体积混合 | |
| D. | 1×10-3mol/L的盐酸和4×10-4mol/L的Ba(OH)2溶液各取10mL,混合后再稀释100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
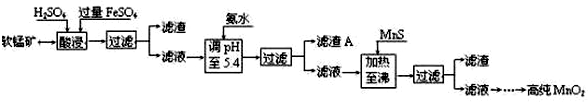
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
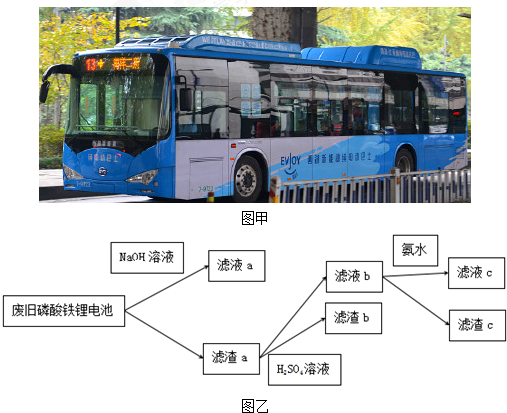
| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 3:2 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=3的溶液中:AlO2-、Al3+、Cl-、SO42- | |
| B. | 含有大量Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | 由水电离的c(H+)=10-11 mol•L-1的溶液中,K+、Na+、Cl-、SO42- | |
| D. | c(H+)<c(OH-)的溶液中:Na+、NH4+、CO32-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
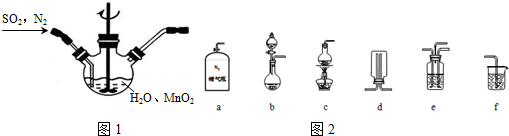
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com