
| ||
| ||
| 84g×2×0.73g |
| 62g |
| 2.51g |
| 106g/mol |


科目:高中化学 来源: 题型:
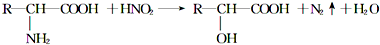
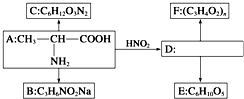
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、K+不一定存在 |
| B、K+、NH4+、CO32-、SO42- 一定存在 |
| C、Cl-一定存在 |
| D、Cl-、Mg2+、Ba2+一定不存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
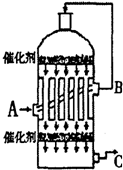 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸. | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、φ1>φ2 |
| B、n1>n2 |
| C、n1=n2 |
| D、φ1<φ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
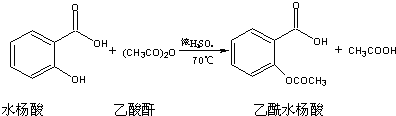

| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将少量产品加入6mL水的试管A中,振荡,将上层液体倾析至B、C中. | 得到白色晶体和无色溶液 | |
| ② | 产品中不含Na2SO4 | ||
| ③ | 向试管C中, | 产品中不含水杨酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com