
【题目】在恒温、恒容条件下,不能表示H2(g)+I2(g) ![]() 2HI(g)达到化学平衡状态的是( )
2HI(g)达到化学平衡状态的是( )
A. 单位时间内消耗a mol H2的同时消耗2a mol HI
B. 容器内的总压强不随时间变化
C. 容器内H2、I2不再减少,HI不再增加
D. 混合气体的颜色不再发生变化
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,8gO2含有16NA个电子
B. 1 molL-1MgCl2溶液中含有氯离子个数为2NA
C. 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
D. 常温常压下,22.4L的NO2和CO2混合气体含有2NA个O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1NaHSO3(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如右图。据图分析,下列判断不正确的是
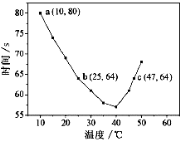
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率不等
C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D.温度高于40℃时,淀粉适宜用作该试验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑上述反应中能设计成原电池的是______。
(2)将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲_______乙(填“>”、“<“或“=” )
③请写出图中构成原电池的负极电极反应式_________________________。
④当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为____________________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入_____________极(填a或b),电子从 __________(填a或b)极流出。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL/SPT) | 50 | 120 | 232 | 290 | 310 |
(1)上述时间段中(填0~1、1~2、2~3、3~4、4~5 min)反应速率最大的是
_____________min,其主要原因是_____________。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率__________________ 。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号) __________ 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
(Ⅱ)某同学做同周期元素性质递变规律实验时,自己设计了—套实验方案,并记录了有关实验现象如下表(表中的“实验方案”与“实验现象”前后不—定是对应关系)
实验方案 | 实验现象 |
①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色。 |
②钠与滴有酚酞试液的冷水反应 | B.有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色。 |
③镁带与2mol/L盐酸反应 | C.反应不十分剧烈,产生的气体可以在空气中燃烧。 |
④铝条与2mol/L盐酸反应 | D.生成白色胶状沉淀,继而沉淀消失。 |
⑤向氯化铝溶液中滴加氢氧化钠溶液至过量 | E.剧烈反应,产生的气体可以在空气中燃烧。 |
请你帮助该同学整理并完成实验报告
(1)实验目的:_________________。
(2)实验用品:仪器:①砂纸,②试管,③胶头滴管,④酒精灯,⑤试管夹、试管架,⑥滤纸,⑦镊子,⑧小刀,⑨玻璃片,⑩锥形瓶(100mL)等;
药品:钠、镁条、铝条、2mol/L,的盐酸、AlCl3溶液、氢氧化钠溶液等。
(3)填写与实验方案相对应的实验现象(从上表“实验现象”中选择),并完成有关离子方程式
实验方案 | 实验现象(填写字母代号) | 有关离子方程式 |
① | _________ | Mg+2H2O(热水)==Mg(OH)2+H2↑ |
② | _________ | _____________________ |
③ | _________ | Mg+2H+==Mg2++H2↑ |
④ | _________ | ___________________ |
⑤ | _________ | Al3+ + 3OH- = Al(OH)3↓ |
___________________ |
(4)实验结论:_____________________
(5)该同学在本实验④中用去m克纯固体,反应完毕后无固体剩余,共收集到VL气体(SPT)下,该同学欲求此固体的原子量的表达式为________(用含m和V的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟电化学反应装置图。下列说法正确的是( )

A.开关K置于N处,则铁电极的电极反应式为:Fe-2e-=Fe2+
B.开关K置于N处,可以减缓铁的腐蚀
C.开关K置于M处,则铁电极的电极反应式为: 2Cl--2e-=Cl2↑
D.开关K置于M处,电子从碳棒经开关K流向铁棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《汉书·食货志》记载“金谓五色之金也,其黄者曰金,白者曰银,赤者曰铜,黑者曰铁……”文中所述金属能与浓盐酸反应生成氢气的是
A. 金 B. 银 C. 铜 D. 铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com