
| 6 |
| 8 |
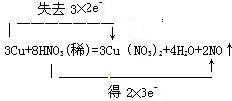 ,故答案为:
,故答案为: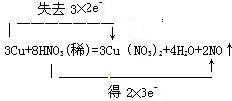 .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、Na+、NO3-、Cl- |
| B、Mg2+、NH4+、SO42-、NO3- |
| C、H+、K+、Cl-、CH3COO- |
| D、Fe3+、K+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
| B、氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+ |
| C、Ca(HCO3)2溶液中滴加过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| A | 纯碱 | HNO3 | 胆矾 | SO2 |
| B | 烧碱 | H2SO4 | NaCl | CO |
| C | 苛性钠 | CH3COOH | 石灰石 | NO2 |
| D | 熟石灰 | H2CO3 | 苏打 | SiO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
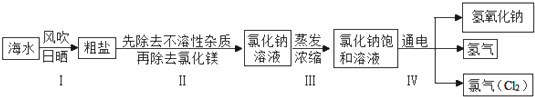

| 阴离子 阳离子 | OH- | CO
| ||
| Ca2+ | 微 | 不 | ||
| Mg2+ | 不 | 微 |
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取一定量的氯化钠溶液于试管中,加入适量的NaOH溶液 | 无明显现象 | 说明MgCl2 |
| 步骤二:往步骤一所得溶液中加入适量的 | 产生白色沉淀 | 说明溶液中含有CaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com