
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.78gNa2O2固体中含有的阴离子数为NA
B.标准状况下,2.24L氖气所含原子数为0.2NA
C.1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA
D.标准状况下,2.24L己烷含有分子的数目为0.1NA
科目:高中化学 来源:2015届江苏省沭阳县高二下学期期中调研测试化学试卷(解析版) 题型:选择题
已知25℃、101kPa条件下:
4Al (s) + 3O2 (g)=2Al2O3 (s) △H=-2834.9 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H= -3119.91kJ/mol
由此得出的结论正确的是
A.等质量的O2比O3能量低,由O2变O3 为放热反应
B.等质量的O2比O3能量低,由O2变O3 为吸热反应
C.3O2(g)=2O3 (g) △H=285.0 kJ/mol
D.O3比O2稳定,由O2变O3 为吸热反应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是

A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:填空题
(12分)铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石
(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等。
(1)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是
可燃性气体,则其反应的化学方程式为 。 该可燃气体在酸性
条件下,可制成燃料电池,写出该气体发生的电极反应式 。
(2)在常温下,铁跟水不起反应。但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe203)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整。
① 原电池反应:
负极:2Fe-4e-=2Fe2+、正极: ;
② 氢氧化物的形成: Fe2 + + 2OH-= Fe(OH) 2↓ 。
③ 氢氧化物的分【解析】
2Fe(OH)3 =Fe2O3+3H2O。
(3)为了防止铁生锈,可在铁制品表面镀上一层铜(如图装置),a为 (填“正极”或“负极”),
铁制品表面发生的电极反应式 为 。

查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g)在常温下不能发生,则该反应的△H>0
B.0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中 的值减小
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是
①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料;⑥2M+N=2P+2Q ,2P+M= Q
(M、N为原料,Q为期望产品),其中符合“化学反应的绿色化”的要求的是
A.①③④⑤ B.②③⑤⑥ C.①②③④ D.②④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
2SO2(g)+O2(g) 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
|
| 甲 | 乙 | 丙 | 丁 |
起始物质的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
含硫反应物的平衡转化率% | 80 |
|
|
| |
下列判断中,正确的是
A.乙中SO3的平衡转化率为 1=20% B.平衡时,丙中c(SO3)是甲中的2倍
1=20% B.平衡时,丙中c(SO3)是甲中的2倍
C.平衡时,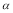 3<
3<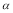 1 D.该温度下,平衡常数的值为400
1 D.该温度下,平衡常数的值为400
查看答案和解析>>
科目:高中化学 来源:2015届广西桂林市高三上学期第一次月考化学试卷(解析版) 题型:实验题
(12分)某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)

(1) MgCO3的分解产物为 。
(2) 装置C的作用是 ,处理尾气的方法为 。
(3) 将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯给装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
已知:3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色)
① 乙组得到的黑色粉末是 ;
② 甲组步骤1中反应的离子方程式为 ;
③ 乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因及其验证方法为
;
④ 从实验安全考虑,上图装置还可采取的改进措施是 ;
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
化学环境、材料、信息、能源关系密切,下列说法不正确的是
A.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体
B.将“地沟油”蒸馏可以获得汽油
C.对废旧电池进行回收处理主要是为了防止重金属污染水源
D.半导体行业中有一句话:“从沙滩到用户”,说明计算机芯片的材料是硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com