
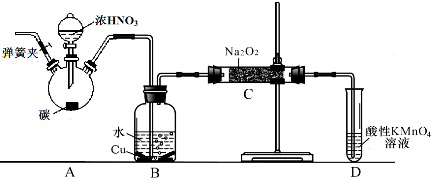


科目:高中化学 来源:不详 题型:单选题
| A.用蒸馏方法提纯水 | B.乙醛的银镜反应 |
| C.实验室制乙烯 | D.实验室制取硝基苯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
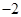 价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:

 =
=


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
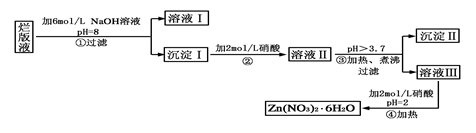
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
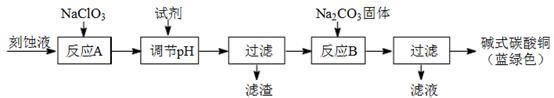
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
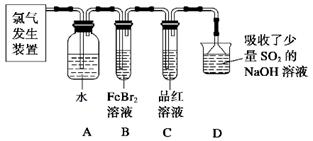
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
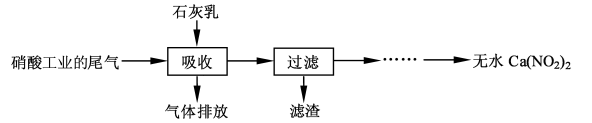
 N2O3(g),其平衡常数表达式为K = 。
N2O3(g),其平衡常数表达式为K = 。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下: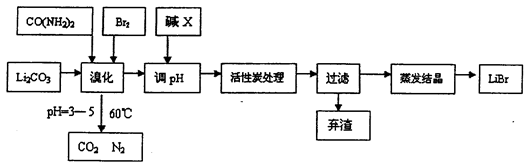
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.制取氢气 | B.制取碳酸钠 |
| C.制取氯化铜 | D.测定盐酸的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
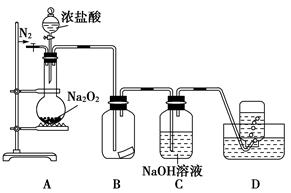
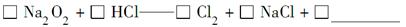
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com