
下列存在丁达尔现象的分散系是( )
①有尘埃的空气
②溴水
③蒸馏水
④沸水中加入适量饱和FeCl3的溶液至溶液变为透明的红褐色液体
⑤淀粉的溶液
A.①②③⑤ B.①④⑤ C.②③ D.②③⑤
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2016届天津市五区县高一上学期期末考试化学试卷(解析版) 题型:选择题
分类法在化学科学中起着非常重要的作用,下列各组物质中,在物质分类里,前者从属于后者的一组是 ( )
A.金属,化合物
B.金属氧化物,碱性氧化物
C.SiO2分散系,胶体
D.单质,纯净物
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高一上学期期末质量检测化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24 L SO3所含分子数目为0.1NA
B.6.0gSiO2中含氧分子的数目为0.1NA
C.78g Na2O2固体中含Na+离子的数目为NA
D.2.3gNa完全燃烧后失去电子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
用一充满氨气的烧瓶做喷泉实验,当水充满整个烧瓶后,烧瓶内氨水的物质的量浓度是(按标准状况下计算)( )
A.0.045 mol·L-1 B.1 mol·L-1
C.0.029 mol·L-1 D.不能确定
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
已知1~18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.离子的还原性:Y2—>Z —
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:选择题
少量二氧化碳通入NaCN溶液中,发生如下反应:CO2 + H2O + CN- =HCO3- + HCN。以下说法正确的是(温度均为25℃)
A.电离常数:K(HCN) <Ka2 (H2CO3)
B.浓度均为0.1mol·L-1的NaCN和NaHCO3溶液的pH:NaCN <NaHCO3
C.浓度均为0.1mol·L-1的NaCN和Na2CO3溶液中,阴离子总浓度相等
D.pH均为10的 Na2CO3溶液、NaCN溶液中,水电离产生的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高二下学期第一次月考化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① |
|
| |||||
2 |
|
|
| ② | ③ | ④ |
|
|
3 | ⑤ |
| ⑥ |
| ⑦ |
| ⑧ | ⑨ |
4 | ⑩ |
|
|
|
|
|
|
|
(1)写由上述元素组成的分子中电子总数为10的分子(至少两种): 。
(2)比较:②、③、④、⑤的第一电离能: > > > (写元素符号)。
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ;碱性最强的化合物的电子式是:
(4)具有两性的最高价氧化物是 (填化学式);写出其与氢氧化钠溶液反应的离子方程式: 。
(5)下表为原子序数依次增大的短周期元素A~E的第一到第五电离能数据。
电离能I(eV)AB C D E
I111.313.65.27.66.0
I224.435.149.315.018.8
I347.954.971.680.128.4
I464.577.498.9109.2112.0
I5392.1113.9138.3141.3153.7
试回答:表中可能为非金属元素的是 (填字母);若D、E为同周期相邻元素,表中D比E的第一电离能略大,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:填空题
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2 2NH3 △H= - 92.4kJ/mol
2NH3 △H= - 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
此温度下该反应的平衡常数K= 。
②欲提高H2的转化率,下列措施可行的是 。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g) 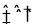 2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
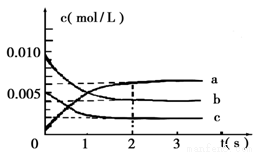
①用O2表示从0~2s内该反应的平均速率v=___________。
②能说明该反应已经达到平衡状态的是_________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。4CO(g)+2NO2(g)  4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
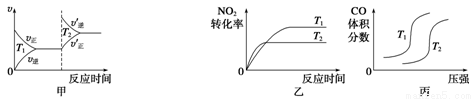
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com