
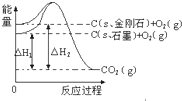
| A. | C(s石墨)=C(s金刚石)△H=+1.9 kJ•mol-1 | |
| B. | 金刚石的稳定性大于石墨 | |
| C. | 石墨和金刚石转化是物理变化 | |
| D. | 1 mol石墨本身具有的总能量比1 mol金刚石本身具有的总能量大1.9 kJ |
分析 先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,根据能量守恒解答解答.
解答 解:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1,故A正确;
B、金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故B错误;
C、石墨转化为金刚石是发生的化学反应,属于化学变化,故C错误;
D、依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,所以1mol石墨本身具有的总能量比1mol金刚石本身具有的总能量小1.9 kJ,故D错误;
故选A.
点评 本题考查热化学方程式的书写及应用,题目难度不大,注意物质的稳定性与能量的关系.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷;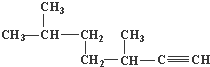 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔; ;
;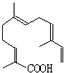 所示,分子式为C15H22O2;该物质可以与下列ABCD(填序号)发生反应.
所示,分子式为C15H22O2;该物质可以与下列ABCD(填序号)发生反应. 中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 所加试剂(填化学式) | 离子方程式 |
| ①Mg(OH)2(Al(OH)3) | ||
| ②NaHCO3溶液(Na2CO3) | ||
| ③FeCl2溶液(FeCl3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的不饱和度Ω为( )
的不饱和度Ω为( )| A. | 8 | B. | 7 | C. | 6 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(s,石墨)═C(s,金刚石)△H=+1.9KJ/mol 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa、25℃时,H2的燃烧热为△H=-285.8KJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-285.8KJ/mol | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丁>丙>乙 | |
| B. | 甲的气态氢化物的水溶液呈酸性 | |
| C. | 乙与丙形成的化合物既能与酸反应,又能与碱反应 | |
| D. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com