
下列有关物质结构的表述正确的是( )
A.次氯酸的电子式H:![]() :
:![]() :
:
B.二氧化硅的分子式:SiO2
C.硫原子的最外层电子排布式:3s23p4
D.钠离子的结构示意图: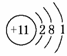
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
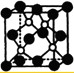 已知A、B、C、D四种短周期元素在周期表中的相对位置如表,其中D的原子序数是A的原子序数的3倍.A与D组成的物质是一种超硬耐磨涂层材料,图为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构.下列有关说法正确的是( )
已知A、B、C、D四种短周期元素在周期表中的相对位置如表,其中D的原子序数是A的原子序数的3倍.A与D组成的物质是一种超硬耐磨涂层材料,图为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构.下列有关说法正确的是( ) 
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
为了比较温室效应气体对目前全球增温现象的影响, 科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。结合表中列出的九种气体,
试 参与回答下列各题: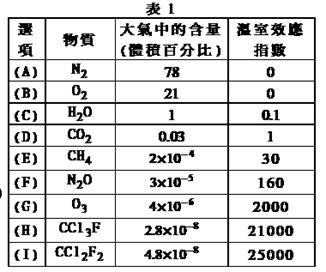
(1)下列由极性键形成的极性分
子是 。
A.N2 B.O2
C.H2O D.CO2
E.CH4
(2)下列说法不正确的是 。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B. C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的 。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体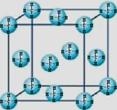
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某红紫色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成, 且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为 。
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O B.[ Co(NH3)5(H2O)]Cl3
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ CoCl(NH3)5]Cl2·H2O。
(6)题(5)中钴离子在基态时核外电子排布式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。
(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子排布式为_______,铝元素的原子结构示意图为_________。
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是_____________(用离子符号表示)。在短周期中非金属性最强的元素位于第____周期____族。
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律。下列有关说法正确的是___________(选填编号)。
a.三种元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加![]()
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性。第三周期主族元素的电负性如下:
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
从上表可以看出电负性的大小与元素非金属性的强弱关系是____________________;大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律,AlBr3中的化学键类型应该是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市高三上学期期中考试化学试卷(解析版) 题型:填空题
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等
|
|
|
J |
|
|
|
|
|
|
|
R |
M的气态原子逐个失去1~ 4个电子所需能量(电离能)如下表所示,
|
|
I1 |
I2 |
I3 |
I4 |
…… |
|
电离能(kJ/mol) |
578 |
1817 |
2745 |
11578 |
…… |
(1)M的电子排布式为________;元素T在周期表中的位置为________。
(2)J和氢能形成多种化合物,其中分子成直线型的,且相对分子质量最小的物质的结构式为________。
(3)M和T形成的化合物在潮湿的空气中冒白雾,反应的化学方程式为_________________。
(4)由J、R形成的液态化合物JR2 0.2 mol在O2中完全燃烧,生成两种气态氧化物,298 K时放出热量215 kJ。该反应的热化学方程式为________。
(5)能源材料已成为当今科学研究的热点。氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是_______(填序号)。
a. C60、Si60、N60都属于新型化合物
b. C60、Si60、N60互为同分异构体
c. 已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d. 已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石
查看答案和解析>>
科目:高中化学 来源:上海市闵行区2010届高三第二次模拟考试化学试卷 题型:填空题
(8分)钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。
(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子排布式为_______,铝元素的原子结构示意图为_________。
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是_____________(用离子符号表示)。在短周期中非金属性最强的元素位于第____周期____族。
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律。下列有关说法正确的是___________(选填编号)。
a.三种元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性。第三周期主族元素的电负性如下:
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.8 |
2.1 |
2.5 |
3.0 |
从上表可以看出电负性的大小与元素非金属性的强弱关系是____________________;大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律,AlBr3中的化学键类型应该是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com