
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈.发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe 和X.
(1)根据题意,可判断出X是 (写化学式).
(2)写出并配平该反应的化学方程式:
(3)发生氧化反应的物质是 ,反应中4mol的氧化剂能 (填“失去”或“得到”) mol电子.
(4)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的质量为 .
考点: 氧化还原反应的计算;氧化还原反应.
专题: 氧化还原反应专题.
分析: (1)焊药为氯化铵,由其作用是消除焊接处的铁锈可知反应物,利用元素守恒来分析X;
(2)Fe元素的化合价降低、N元素的化合价升高,利用电子守恒及质量守恒定律来配平反应;
(3)由生成氮气时转移的电子来计算;
(4)根据化学方程式及起氧化剂作用的氧化铁来计算.
解答: 解:(1)根据焊药为氯化铵,其作用是消除焊接处的铁锈可知反应物为NH4Cl、Fe2O3,
则该反应得生成物为FeCl3、N2、Fe和X,
根据元素守恒可知X中含有H、O元素,则X为H2O,
故答案为:H2O;
(2)由反应物和生成物可知,
NH4Cl+Fe2O3→Fe+FeCl3+N2↑+H2O,
该反应Fe元素的化合价由+3价降低为0,N元素的化合价由﹣3价升高到0,
根据电子守恒可知,得电子数=失去电子数=18e﹣,则
6NH4Cl+Fe2O3→6Fe+FeCl3+3N2↑+H2O,
再质量守恒定律可知,配平的化学反应为6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O,
故答案为:6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O;
(3)反应6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O中,N元素化合价升高,被氧化,Fe元素化合价降低,由+3价降低到0价,被还原,Fe2O3为氧化剂,由方程式可知,当4molFe2O3参加反应时,有6mol被还原,如4molFe2O3部被还原,应得到24mol电子,
故答案为:NH4Cl;得到;24;
(4)(4)11.2L(标准状况)的气体,其物质的量为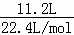 =0.5mol,
=0.5mol,
由6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O可知,
气体与起氧化剂作用的氧化铁得关系为,3N2~3Fe2O3,
则被还原的物质的质量为0.5mol×160g/mol=80g,
故答案为:80.
点评: 本题考查氧化还原反应得配平及有关计算,根据电子守恒及质量守恒定律得出化学反应方程式是解答本题的关键,并注意(3)是学生解答的难点和易错点,4mol Fe2O3参与反应与作氧化剂的区别,难度中等.


科目:高中化学 来源: 题型:
某温度下,对于反应N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是()
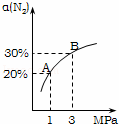
A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
B. 平衡状态由A变到B时,平衡常数K(A)<K(B)
C. 上述反应在达到平衡后,增大压强,H2的转化率提高
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
9.75g锌与0.3 mol的盐酸刚好完全反应,放出0.15 mol H2,在溶液中有0.15mol Zn2+离子和0.3 mol Cl﹣离子,把反应后的溶液蒸干,可以得到ZnCl20.15 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是()
A. 次磷酸的电离方程式为H3PO2⇌3H++PO23﹣
B. 次 磷酸中P的化合价为+1
磷酸中P的化合价为+1
C. NaH2PO2是酸式盐
D. NaH2PO2溶液显弱酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32﹣、SO32﹣、SO42﹣、C1﹣中的若干种,现取X溶液进行连续实验,实验过程及产物如图.下列说法正确的是()
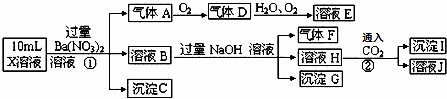
A. 气体A是NO2
B. X中肯定存在Fe2+、A13+、NH4+、SO42﹣
C. 溶液E和气体F不能发生化学反应
D. X中不能确定的离子是 A13+和C1﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是()
A. F结构示意图为:
B. HCl的电子式为:H+
C. Na2O2的形成过程可以表示为: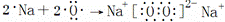
D. 次氯酸(HClO)的结构式为:H﹣Cl﹣O
查看答案和解析>>
科目:高中化学 来源: 题型:
沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热最,则下列热化学方程式中正确的是()
A. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=+890kJ•mol﹣1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJ•mol﹣1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1
D. 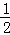 CH4(g)+O2(g)=CO2(g)+H2O(l)△H=﹣890kJ•mol﹣1
CH4(g)+O2(g)=CO2(g)+H2O(l)△H=﹣890kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醛在酸性催化剂存在下三分子聚合可以生成性质相对稳定、毒性小、易于运输的三聚甲醛,反应如图所示.下列说法正确的是()

A. 甲醛水溶液可作为食物防腐剂
B. 该反应类型为缩聚反应
C. 三聚甲醛分子中既含σ键又含п键
D. 常温下,9g三聚甲醛中含1.806×1023个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
能源危机是当前全球问题,开源节流是应对能源危机的重要举措.
(1)下列做法有助于能源“开源节流”的是 (填字母).
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,氧气不足时它们燃烧生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示:
(a)通常状况下,金刚石和石墨中 (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为△H= kJ•mol﹣1.
(b)12g石墨在一定量空气中燃烧,生成气体36g,则该过程共放出的热量 kJ.
(3)已知:N2(g)+O2(g)=2NO(g);△H=+180.0kJ•mol﹣1.综合上述有关信息,请写出用CO除去NO的热化学反应方程式
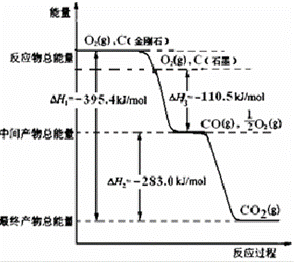
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com