
分析 (1)H2S2分子中,存在H-S键和S-S键,在SO2分子中的S原子的价层电子对数为$\frac{6+0}{2}$=3,据此判断S原子的杂化轨道类型;
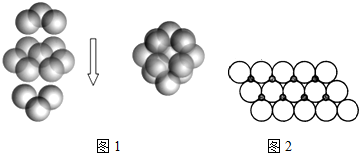
(2)①FeS2的晶体中的Fe2+离子的排列方式如图1所示,每个Fe2+周围最近的等距离的S22-离子存在于面心;
②根据均摊法计算,一个晶胞内含有Fe2+数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有S2-数目为12×$\frac{1}{4}$+1=4,再根据密度ρ=$\frac{m}{V}$计算;
(3)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为$\frac{1}{2}$a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的$\sqrt{2}$倍,根据图片知,每个氧化镍所占的面积=2×1.40×10-10m×2×1.40×10-10m×sin60°,每个氧化镍的质量=$\frac{74.7}{N{\;}_{A}}$g,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量.
解答 解:(1)H2S2分子中,存在H-S键为极性共价键和S-S键为非极性共价键,在SO2分子中的S原子的价层电子对数为$\frac{6+0}{2}$=3,所以S原子的杂化轨道类型为sp2杂化,
故答案为:极性共价键、非极性共价键;sp2;
(2)①每个Fe2+周围最近的等距离的S22-离子存在于面心,共有6个,
故答案为:6;
②一个晶胞内含有Fe2+数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有S2-数目为12×$\frac{1}{4}$+1=4,一个晶胞的质量m=$\frac{120g/mol×4}{N{\;}_{A}}$,一个晶胞体积V=a03,则晶胞密度ρ=$\frac{m}{V}$=$\frac{120g/mol×4}{(0.54×10{\;}^{-7}cm){\;}^{3}×6.02×10{\;}^{23}}$=5.06g•cm-3,
故答案为:5.06.
(3)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为$\frac{1}{2}$,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的$\sqrt{2}$倍,所以其距离是$\frac{\sqrt{2}}{2}$acm;根据图片知,每个氧化镍所占的面积=2×1.40×10-10m×2×1.40×10-10m×sin60°,则每平方米含有的氧化镍个数=$\frac{1}{2.80×10{\;}^{-10}m×2.80×10{\;}^{-10}m×sin60°}$,每个氧化镍的质量=$\frac{74.7}{N{\;}_{A}}$g,所以每平方米含有的氧化镍质量═$\frac{74.7}{N{\;}_{A}}$×$\frac{1}{2.80×10{\;}^{-10}m×2.80×10{\;}^{-10}m×sin60°}$=1.83×10-3,
故答案为:$\frac{\sqrt{2}}{2}$a,1.83×10-3.
点评 本题考查较综合,涉及电子排布式的书写、杂化方式的判断、晶胞的计算等知识点,难度较大,难点是晶胞的计算,注意(3)中氧化镍化学式的平面结构是平行四边形,而不是三角形,为易错点,.


科目:高中化学 来源: 题型:选择题
| A. | 饱和(NH4)2SO4、CuSO4溶液都能使蛋白质溶液发生盐析 | |
| B. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| C. | 糖类、油脂和蛋白质都是天然高分子化合物 | |
| D. | 福尔马林、葡萄糖都能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | W | Z | 反应体系能量变化 | |
| 甲 | 2mol | 1mol | 放出akJ/mol | ||
| 乙 | 1mol | 1mol | 放出bkJ/mol | ||
| 丙 | 2mol | 2mol | 放出ckJ/mol | ||
| 丁 | 3mol | 2mol | 吸收dkJ/mol |
| A. | c+d<Q | |
| B. | 平衡时,甲、丁容器中X、W的转化率之和大于1 | |
| C. | 平衡时丙容器中Z的物质的量浓度最大 | |
| D. | X的转化率为:甲<乙<丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
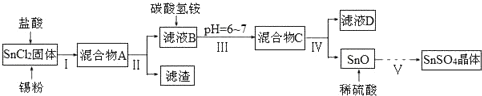
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | s区、d区、ds区都是金属元素 | |
| B. | p区都是主族元素 | |
| C. | 所有族中IIIB中元素种类最多 | |
| D. | 最外层电子数为2的元素都分布在s区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素符号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| A. | 14X可用与测定文物年代 | B. | Z的非金属性比T强 | ||
| C. | Y和T位于同一主族 | D. | X元素形成的化合物种类很多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂、加热}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{HCi(aq)}{→}$MgCl2(aq)$\stackrel{△}{→}$ 无水MgCl2 | |
| C. | Al2O3$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$ 固体Al(OH)3 | |
| D. | CH2═CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{△}^{CuO}$CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题:
过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
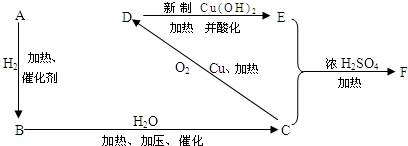
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com