
| A. | KSCN溶液 | B. | 氢氧化钠溶液 | C. | 氯水 | D. | 铜粉 |
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某学生课外活动小组利用图所示装置做实验:在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅直至褪色,冷却后恢复红色,则原溶液可能是( )
某学生课外活动小组利用图所示装置做实验:在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅直至褪色,冷却后恢复红色,则原溶液可能是( )| A. | 溶有SO2的品红溶液 | B. | 滴有酚酞的氨水溶液 | ||
| C. | 滴有酚酞的NaOH溶液 | D. | 滴有石蕊的盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
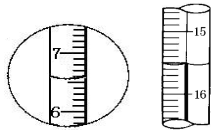
| A. | 左边是量筒读数6.5mL,右边是滴定管读数16.50mL | |
| B. | 左边是量筒读数7.5mL,右边是滴定管读数16.50mL | |
| C. | 左边是量筒读数6.5mL,右边是滴定管读数15.50mL | |
| D. | 左边是量简读数6.5mL,右边是滴定管读数16.50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| B. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO | |
| C. | SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 | |
| D. | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀的PH | 沉淀完全的PH |
| Cr3+ | 4.9 | 6.8 |
| Fe3+ | 1.5 | 4.1 |
| 物质 | 溶解度/(g/110g水) | ||
| 0℃ | 40℃ | 80℃ | |
| K2SO4 | 7.4 | 14.8 | 21.4 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| 实验序号 | 待测样品溶液的体积/mL | 0.1000mol/L摩尔盐溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 24.98 |
| 2 | 25.00 | 1.56 | 29.30 |
| 3 | 25.00 | 1.00 | 26.02 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com