
【题目】将14g铜银合金与足量的HNO3反应,放出的气体与标准状况下体积为1.12L的O2 混合后再通入水中,恰好全部吸收,则合金中铜的质量为
A. 4.8g B. 3.2g C. 6.4g D. 10.8g
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】CO、NO2等有毒气体的转化以及氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素[CO(NH2)2]的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H= -159.47kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=akJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H= -86.98kJ·mol-1
则a=_______。
(2)反应2NH3(g)+CO2(g)![]() CO(NH2)2(1)+H2O(g),在合成塔中进行。右图中I、II、III三条曲线为合成塔中按不同氨碳比和水碳比投料时二氧化碳转化率的情况。曲线I、II、III水碳比的数值分别为:
CO(NH2)2(1)+H2O(g),在合成塔中进行。右图中I、II、III三条曲线为合成塔中按不同氨碳比和水碳比投料时二氧化碳转化率的情况。曲线I、II、III水碳比的数值分别为:
I.0.6~0.7 II.1~1.1 III.1.5~1.61
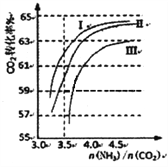
生产中应选用水碳比的数值为__________(选填序号)。
(3)4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1 ,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是_____(填代号)。
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1 ,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是_____(填代号)。
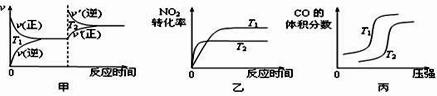
(4)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_______(填字母代号)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率_________(填“升高”或“降低”),ΔH___________0(填“>”或“<”).
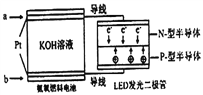
(5)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。电池反应为:4NH3+3O2=2N2+6H2O;请写出通入a气体一极的电极反应式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____________。
(2)该反应中发生氧化反应的物质是__________,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(3)48.0 g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4 L气体(标准状况下),反应中消耗HNO3的物质的量可能是( )
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质: FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3 + ______ ![]() ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并写出配平后的离子方程式:_________________________。
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念——“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是( )
A.Cu ![]() Cu(NO3)2
Cu(NO3)2
B.Cu ![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu ![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2 ![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是
A.金属钠投入蒸馏水2 Na+2H2O=2 Na+ +2OH- +H2↑
B.向亚硫酸钠溶液中加入足量硝酸SO3 2- +2 H+ =SO2↑+ H2O
C.用浓盐酸与MnO2反应制取少量氯气MnO2+4H++2C1- = Mn2+ + 2H2O+Cl2↑
D.硫酸亚铁溶液中加入酸化的双氧水Fe2++2H++H2O2 = Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组混合物,不能用分液漏斗分开的是( ) ①四氯化碳、水 ②乙醇、甘油 ③乙醇、水 ④苯、水 ⑤已烷、水 ⑥环已烷、苯 ⑦溴苯、水.
A.①②③
B.②③⑥
C.①④⑤⑦
D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)在标准状况下,CO和CO2混合气体的质量为32g,体积为22.4L,则其中CO与CO2物质的量之比为_____________,所含O原子的数目为_____________;将其中的CO2与足量的过氧化钠反应,反应中转移电子的物质的量为_____________。
(2)在实验室将16.8g固体NaHCO3加热一段时间后,测得剩余固体的质量变为13.7g。则减少的为_______物质的质量,有______gNaHCO3发生了分解反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com