
| A、分子中的所有原子均达到8电子稳定结构 |
| B、分子中N-C1键键长与CCl4分子中C-Cl键键长相等 |
| C、NCl3分子是平面三角形非极性分子 |
| D、NBr3比NCl3易挥发 |


科目:高中化学 来源: 题型:
| A、羰基硫分子为非极性分子 |
B、羰基硫的电子式为: |
| C、羰基硫沸点比CO2高 |
| D、羰基硫分子中三个原子处于同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 | ||||
| B、原子最外层电子数为2的元素一定处于元素周期表ⅡA族 | ||||
| C、NaOH和Na2O中所含的化学键类型完全相同 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、73% | B、24% |
| C、36% | D、12% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将浓硫酸和乙醇混合加热140℃制乙烯 |
| B、用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热,产生砖红色沉淀 |
| C、CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
| D、苯和浓溴水反应制溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时X的浓度为0.2mol?L-1 |
| B、a的值为2 |
| C、反应速率v(Y)=0.3mol?(L?min)-1 |
| D、Y的转化率为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11g T216O含有的中子数为6NA |
| B、1mol Na2O2与CO2完全反应转移的电子数为2NA |
| C、1mol Na2O2固体中含离子总数为4NA |
| D、标准状况下,2.24L H2O所含共价键数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
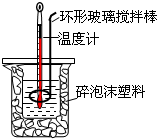 测定中和热实验装置如图:
测定中和热实验装置如图:| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com