
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:

(1)Na2MoO4·2H2O中钼元素的化合价为______;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是_______(答出一条即可);
(3)试配平焙烧过程中钼精矿发生的主要反应的化学方程式
为__MoS2+__O2![]() __MoO3+___SO2,该反应中氧化产物是________(填化学式)
__MoO3+___SO2,该反应中氧化产物是________(填化学式)
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___________;
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:

①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是____。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是__。
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
【答案】 +6 将矿石粉碎(或增加空气的进入量或采用逆流原理等) 2 7 2 4 MoO3、SO2 MoO3+CO32-=MoO42-+CO2↑ Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧化性增强,会使钢铁钝化,腐蚀速率减慢 替代空气中氧气起氧化剂作用 nMoS2+xLi++xe-=Lix(MoS2)n
【解析】(1). 根据化合物中元素化合价代数和为0,Na2MoO4·2H2O中钼元素的化合价为+6价,故答案为:+6;
(2). 焙烧时为了使钼精矿充分反应,可采取的措施是将矿石粉碎或增加空气的进入量或采用逆流原理等,故答案为:将矿石粉碎(或增加空气的进入量或采用逆流原理等);
(3). 焙烧过程中MoS2和O2反应生成MoO3和SO2,Mo元素的化合价从+2价升高到+6价、S元素的化合价从-1价升高到+4价,O元素的化合价从0价降低到-2价,根据得失电子守恒和原子守恒,配平后的化学方程式为:2MoS2+7O2![]() 2MoO3+4SO2,还原剂是MoS2,所以该反应的氧化产物是MoO3、SO2,故答案为:2;7;2;4;MoO3、SO2;
2MoO3+4SO2,还原剂是MoS2,所以该反应的氧化产物是MoO3、SO2,故答案为:2;7;2;4;MoO3、SO2;
(4). 由流程图可知,碱浸时MoO3与Na2CO3反应生成CO2和Na2MoO4,该反应的离子方程式为:MoO3+CO32-= MoO42-+CO2↑,故答案为:MoO3+CO32-= MoO42-+CO2↑;
(5). ①. 由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于在硫酸中的腐蚀速率,说明Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸浓度增大变成浓硫酸后,氧化性增强,使碳钢发生了钝化,腐蚀速度减慢,故答案为: Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧化性增强,会使钢铁钝化,腐蚀速率减慢;
②. NaNO2具有氧化性,能够在钢铁表面形成FeMoO4—Fe2O3保护膜,可以替代空气中的氧气起氧化剂作用,故答案为:替代空气中氧气起氧化剂作用;
(6). 由题中所给的总反应式可知,该电池放电时,MoS2在正极上得到电子生成Lix(MoS2)n,电极反应式为:nMoS2 + xLi+ + xe- = Lix(MoS2)n,故答案为:nMoS2 + xLi+ + xe- = Lix(MoS2)n。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是
A.HCO3―、Na+、OH―、K+B.CO32―、Ba2+、K+、NO3―
C.Ba2+、OH―、Cl―、Na+D.CO32―、Na+、NO3―、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中化合物的性质比较,正确的是( )
A.酸性:HClO>HBrO4>HIO4
B.碱性:Al(OH)3>Mg(OH)2>NaOH
C.稳定性:PH3>H2S>HCl
D.非金属性:F>O>S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用下列试剂中的一种就能将FeCl3、CuCl2、MgCl2和NaCl四种溶液区别开的是 ( )
A. H2SO4溶液 B. BaCl2溶液 C. NaOH溶液 D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJmol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196kJmol-1
H2(g)+![]() O2(g)═H2O(l)△H=-285kJmol-1
O2(g)═H2O(l)△H=-285kJmol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为__________________
(2)①在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl(氯化亚铜)沉淀,同时溶液的酸性增强.制备CuCl的离子方程式是___________
②在![]() 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,![]() ________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
③若在0.15![]() 硫酸铜溶液中通入过量
硫酸铜溶液中通入过量![]() 气体,使
气体,使![]() 完全沉淀为CuS,此时溶液中的
完全沉淀为CuS,此时溶液中的![]() 浓度是______
浓度是______![]()
(3)工业上常用氨水吸收H2S进行废气脱硫,生成NH4HS。一定温度下1molNH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。下图1是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图1上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线_________________________。

(4)可利用H2S废气进行高温热分解制取氢气,实现化废为宝。
已知:![]()
在恒温密闭容器中,控制不同温度进行![]() 分解实验。以
分解实验。以![]() 起始浓度均为0.2
起始浓度均为0.2 ![]() 测定
测定![]() 的转化率,结果见下图。
的转化率,结果见下图。

图中a为![]() 的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时
的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时![]() 的转化率。据图计算985℃时
的转化率。据图计算985℃时![]() 按上述反应分解的平衡常数K=______(保留2位有效数字);说明随温度的升高,曲线b向曲线a逼近的原因:_________________________。
按上述反应分解的平衡常数K=______(保留2位有效数字);说明随温度的升高,曲线b向曲线a逼近的原因:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制450 mL 0.5 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液小心转入所选容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为______________(填序号)。
(2)本实验用到的仪器有托盘天平、药匙、玻璃棒、烧杯、__________________。
(3)某同学观察液面的情况如图所示,对所配溶液浓度将有何影响?__________(填“偏高”“偏低”或“无影响”)。
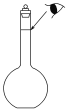
(4)若出现如下情况,对所配溶液浓度将有何影响?加蒸馏水时不慎超过了刻度__________。(填“偏高”“偏低”或“无影响”)
(5)若使用5 mol·L-1的NaCl溶液稀释来配制450 mL 0.5 mol·L-1的NaCl溶液,则需要5 mol·L-1的NaCl溶液________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在1965年9月首先用人工方法合成牛胰岛素。为了证实人工合成的胰岛素与天然的是否是同一物质,在人工合成牛胰岛素过程中掺入了放射性14C,然后将人工合成的牛胰岛素与天然的混合得到了放射性14C分布均匀的结晶物,从而证明了两者都是同一种物质,为我国在国际上首先合成具有生物活性牛胰岛素提供了有力证据。在人工合成过程中掺入放射性14C的用途是 ( )
A. 催化剂 B. 媒介质 C. 组成元素 D. 示踪原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种由KCl、NaCl组成的混合物中,钾、钠离子的物质的量之比是1:2,则此混合物中,KCl的质量分数是___________.如果该混合物中含6molCl-,那么,此混合物中有NaCl__________g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com