
科目:高中化学 来源: 题型:
(16分)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热.放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时
n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡, v(H2)=________;该温度下CO(g)+2H2(g) CH3OH(g)的化学平衡常数为_______________ 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”.“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1.P2,且P1<P2)。
(5) 有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A.CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B.CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2012届甘肃省陇东中学高三第四次模拟考试化学试卷 题型:填空题
(18)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)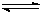 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。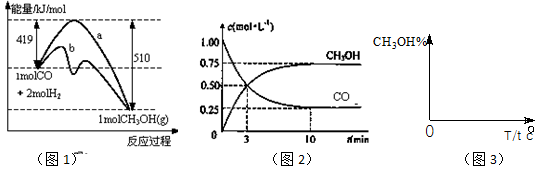
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热、放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不 变,再充入1molCO和2molH2,再次达到平衡时
变,再充入1molCO和2molH2,再次达到平衡时
n(CH3OH)/n(CO)会减小
(3)从 反应开始到建成平衡, v(H2)=________;已知:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,那么在该温度下CO(g)+2H2(g)
反应开始到建成平衡, v(H2)=________;已知:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,那么在该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____
CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5) 有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省珠海市高三9月摸底考试理科综合能力测试(化学部分) 题型:综合题
(16分)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热.放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时
n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡, v(H2)=________;该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为_______________ 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”.“减小”或“不变”)。
CH3OH(g)的化学平衡常数为_______________ 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”.“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1.P2,且P1<P2)。
(5) 有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A.CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B.CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:湖北省模拟题 题型:填空题
 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。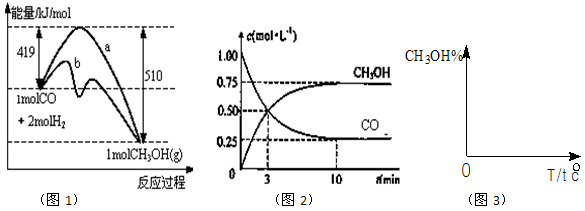
 CH3OH(g)的化学平衡常数为_______________ 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为_______________ 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知::![]()
![]()
![]()
则![]() 的
的![]() =__________________________。
=__________________________。
(2)工业合成氮的反应为![]() 。在一定温度下,将一定量的N
。在一定温度下,将一定量的N![]() 和H
和H![]() 通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
①增大压强 ②增大反应物的浓度
③使用催化荆 ④降低温度
(3) 工业合成氨的反应为![]() 。设在容积为2.0L的密闭容器中充入
。设在容积为2.0L的密闭容器中充入![]() 和
和![]() .反应在一定条件下达到平衡时,NH
.反应在一定条件下达到平衡时,NH![]() 的物质的量分数(NH
的物质的量分数(NH![]() 的物质的量与反应体系中总的物质的量之比)为
的物质的量与反应体系中总的物质的量之比)为![]() 。计算
。计算
①该条件下N![]() 的平衡转化率为______________;
的平衡转化率为______________;
②该条下反应![]() 的平衡常数为_____________。
的平衡常数为_____________。
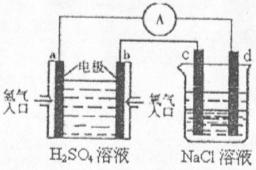
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:(其中c、d均为碳棒。NaCI溶液的体积为500m1)
①a极为________极,电极反应式__________________________;
c极为________极,电极反应式__________________________
②右图装置中,当b极上消耗的O![]() 在标准状况下的体积为280ml时,则NaCl溶液
在标准状况下的体积为280ml时,则NaCl溶液
的PH为_________ (假设反应前后溶液体积不变,且NaCl溶液足量)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com