
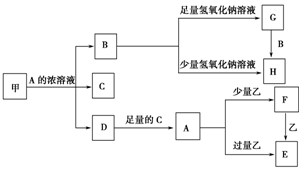
 中学化学中常见的几种物质存在如图关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体.(图中部分产物和反应条件已略去)
中学化学中常见的几种物质存在如图关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体.(图中部分产物和反应条件已略去)分析 D是红棕色气体,说明D是二氧化氮;由甲是黑色非金属单质,且和A的浓溶液反应生成二氧化氮,说明甲是碳,A溶液是浓硝酸,则B是二氧化碳,C是水;二氧化碳和足量氢氧化钠溶液反应生成碳酸钠和水,而二氧化碳和少量氢氧化钠溶液反应生成碳酸氢钠和水,所以G是碳酸钠,而H是碳酸氢钠;二氧化氮和水反应生成硝酸;由硝酸和少量乙反应生成F,和过量乙反应生成E,F和乙又可生成E,可知乙为金属铁,而F为硝酸铁,E为硝酸亚铁,然后进行一一验证即可.
解答 解:(1)D是红棕色气体,说明D是二氧化氮;由甲是黑色非金属单质,且和A的浓溶液反应生成二氧化氮,说明甲是碳,A溶液是浓硝酸,则B是二氧化碳,C是水,反应的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)碳酸氢钠受热分解为碳酸钠、水以及二氧化碳,而碳酸钠受热稳定,可以用加热法除去碳酸钠中的碳酸氢钠,
故答案为:加热;
(3)向硝酸亚铁中加入硫酸,相等于存在硝酸,硝酸可以将亚铁离子氧化,实质是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3 Fe3++NO↑+2H2O;
(4)亚铁离子易被氧化为三价铁,三价铁遇到硫氰酸钾显示红色,亚铁离子的检验方法:取少量试液于试管中,先加入KSCN溶液无变化再加入氯水(或盐酸等)溶液变红色,
故答案为:取少量试液于试管中,先加入KSCN溶液,无明显变化,再加入氯水(或盐酸等)溶液变红色.
点评 本题为框图型物质推断题,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质的化学式,然后顺推或逆推或由两边向中间推得出其他物质的化学式,题目难度中等.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物:铝热剂、液氨、铝合金、酒精 | |
| B. | 化合物:干冰、冰水混合物、烧碱、小苏打 | |
| C. | 电解质:氯化钠、硫酸钡、氯化氢、水 | |
| D. | 同素异形体:活性炭、C60、石墨烯、金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++H++CO32- | B. | NaHSO4=Na++H++SO42- | ||
| C. | H2SO4=2H++SO42- | D. | CH3COOH?CH3COO-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热固体,用湿润的红色石蕊试纸靠近,看颜色变化,用此法鉴别固体是否为铵盐 | |
| B. | 用短胶头滴管向FeSO4溶液滴加NaOH溶液,产生的白色沉淀可长时间存在 | |
| C. | 将金属钠投入CuSO4溶液,可观察到有红色固体析出 | |
| D. | 向25mL沸腾的蒸馏水中逐滴加入5-6滴FeCl3饱和溶液,继续煮沸至溶液红褐色,停止加热,便得到Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去淀粉溶液中的NaCl:加入AgNO3溶液后,静置过滤 | |
| B. | 除去乙烷中少量的乙烯:光照下通入Cl2,生成液态CH2Cl-CH2Cl,气液分离 | |
| C. | 除去CO2中少量的乙烯:通过酸性KMnO4溶液 | |
| D. | 除去乙酸乙酯中的乙酸:用NaOH溶液中和,然后蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com