
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
xA(g)+2B(s)yC(g) ΔH<0
在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
科目:高中化学 来源: 题型:
能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源的能量间接制取的能源称为二级能源。据此判断,下列叙述正确的是( )
A.天然气是二级能源 B.石油是二级能源
C.电能是一级能源 D.水力是一级能源
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
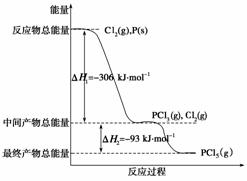
根据上图回答下列问题:
(1) P和Cl2反应生成PCl3的热化学方程式是
________________________________________________________________________
________________________________________________________________________。
(2) PCl5分解成PCl3和Cl2的热化学方程式是
________________________________________________________________________
________________________________________________________________________。
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80 mol PCl5,反应达到平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是
________________________________________________________________________。
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=______,P和Cl2一步反应生成1 mol PCl5的ΔH4________ΔH3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定容积的密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)2C(g) ΔH<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合右图中曲线的是 ( )。
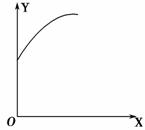
| X | Y | |
| A | 再加入A | B的转化率 |
| B | 加入催化剂 | A的体积分数 |
| C | 充入氦气 | A的转化率 |
| D | 升高温度 | C的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为原子序数依次增大的短周期元素。其形成的小分子化合物Y2X2、Z2X4、X2W2中,分子内各原子最外层电子都满足稳定结构。下列说法正确的是( )
A.X、Y、Z、W的原子半径的大小关系为:W > Y > Z > X
B.在Y2X2、Z2X4、X2W2的一个分子中,所含的共用电子对数相等
C.X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物
D.与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
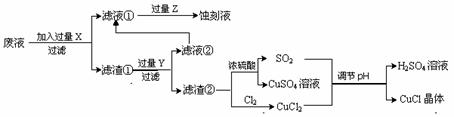
|
根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是接触法,氯碱工业的装置是_____________________。
(2)写出生产过程中X:____ ______ Y:_____ _____ (填化学式)。
(3)写出产生CuCl的化学方程式:_________________________________________。
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是______________________________;生产过程中调节溶液的pH不能过大的原因是:______________________________。
(5)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:
________________________________ _____。
(6)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 ══CuCl2 + FeCl2 Fe2+ + Ce4+ ══ Fe3+ + Ce3+
如此再重复二次测得:
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得CuCl的纯度为____________。(平行实验结果相差不能超过0.3%)
查看答案和解析>>
科目:高中化学 来源: 题型:
右图所示的试管中盛有较浓的氨水,氨水中因加有酚酞而显浅红色。
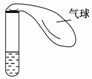
(1)对试管以热水浴的方式加热,观察试管中的溶液,结果是____________(有现象就写明现象的内容,无现象就写明无现象的原因)。
(2)把加热后的试管放入约20℃的水中冷却,观察试管中的溶液里是否有明显的现象,它是________________________________________________________________________
(有现象就写明现象的内容,无现象就写明无现象的原因)。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L; W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径: W>Z>Y>X>M B.XZ2、X2M2、W2Z2均为直线形的共价化合物
C.由X元素形成的单质不一定是导体
D.由 X、Y、Z、M四种元素形成的化合物一定既含有离子键,又含有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com