
分析 乙酸含有随机、乙醇含有羟基,乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,属于酯化反应,也为取代反应,以此解答.
解答 解:(1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,反应的化学方程式为
CH3COOH+CH3CH2OH$?_{加热}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,该反应为酯化反应,属于取代反应的类型,
故答案为:取代;
(2)因乙酸含有羧基,为乙酸的官能团,故答案为:羧基.
点评 本题考查有机物的结构和性质,侧重考查乙酸和乙醇的结构和性质,从官能团入手来判断反应类型,来推断所具有的性质是解有机题的重要方法,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 若0.5molCH4全部和Cl2发生取代反应,生成物质的量相等的四种有机物,则消耗Cl2的物质的量是1.25mol | |
| B. | 将CH3OH和分子式为C3H8O的醇混合,发生分子间脱水反应,可以得到的醚有6种 | |
| C. | 工业上要生产氯乙烷,用CH3CH3与Cl2发生取代反应制取比用CH2═CH2与HCl发生加成反应制取好 | |
| D. | 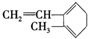 与Br2发生1:1加成反应,其加成产物最多有5种 与Br2发生1:1加成反应,其加成产物最多有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 装碱液的锥形瓶用NaOH溶液润洗 | |
| B. | 滴定时,眼睛注视酸式滴定管中液面的下降情况 | |
| C. | 应用右手控制酸式滴定管的活塞 | |
| D. | 若用甲基橙作指示剂,到滴定终点时锥形瓶内液体为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.500 mol | B. | 1.00 mol | C. | 0.125mol | D. | 0.25 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ④③①②⑤ | C. | ④①②③⑤ | D. | ②③①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
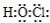 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1•s-1 | B. | 0.15 mol•L-1•s-1 | ||
| C. | 0.2 mol•L-1•s-1 | D. | 0.3mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com