
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
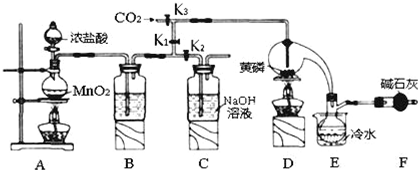
分析 实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,K3利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应,
(1)装置A中发生的反应是MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应式中HCl和MnCl2可拆分,其余仍用化学式表示,最终可得离子方程式;
(2)碱石灰有吸水和吸酸性气体的作用,本实验的尾气氯气有毒,对环境有污染,可被碱石灰吸收,同时还可以防止空气中的水汽进入烧瓶内与PCl3反应;
(3)白磷遇氧易因缓慢氧化而引起自发燃烧,装置中的空气含有氧气,通入干燥的CO2可达到目的;
(4)加入黄磷加热除去PCl5后,粗产品中含有的POCl3和PCl3熔沸点存在明显的差异,结合混合物常见的分离方式,可选择蒸馏操作;
(5)氢氧化钠与氯气反应生成氯化钠和次氯酸钠;
(6)通过滴定原理测定混合物中PCl3的质量分数,可借助于原子守恒并结合关系式PCl3~H3PO3~I2,2Na2S2O3~I2进行计算
解答 解:实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,K3利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应,
(1)A装置中,加热条件下,浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应,
故答案为:吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应;
(3)通入一段时间的CO2可以排尽装置中的空气,防止白磷与空气中的氧气发生自燃,
故答案为:排尽装置中的空气,防止白磷自燃;
(4)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离,
故答案为:蒸馏;
(5)氢氧化钠与氯气反应生成氯化钠和次氯酸钠:Cl2+2OH-=Cl-+ClO-+2H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+2H2O;
(6)0.1000mol•L-1碘溶液10.00mL中含有碘单质的物质的量为:0.1000mol•L-1×0.0100L=0.00100mol,根据反应I2+2Na2S2O3=2NaI+Na2S4O6可知,与磷酸反应消耗的碘单质的物质的量为:0.00100mol-0.1000mol•L-1×0.00084L×$\frac{1}{2}$=0.00058mol,再由H3PO3+H2O+I2=H3PO4+2HI可知,25mL三氯化磷水解后的溶液中含有的H3PO3的物质的量为:n(H3PO3)=n(I2)=0.00058mol,250mL该溶液中含有H3PO3的物质的量为:0.00058mol×$\frac{250}{25}$=0.0058mol,所以1.00g产品中含有的三氯化磷的物质的量为
甄0.0058mol,该产品中PCl3的质量分数为:$\frac{137.5×0.0058}{1}$×100%=79.75%,
故答案为:79.75%.
点评 本题考查阅读获取信息的能力、对实验原理理解等,题目难度较大,是对知识的综合运用,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力,注意题中信息PCl3遇O2会生成POCl3,POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.


科目:高中化学 来源: 题型:选择题
| A. | 蛋白质的变性 | B. | 蛋白质的盐析 | C. | 胶体聚沉 | D. | 盐类水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4Al(SO4)2三种溶液中,c(NH4+由大到小的顺序为:③>②>① | |
| B. | 0.1mol•L-1CH3COOH与0.05mol•L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>cCH3COOH)>c(H+) | |
| C. | 0.1 mol•L-1Na2CO3与0.05mol•L-1 NaHCO3溶液等体积混合: $\frac{3}{5}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mol•L-1NaHC2O4溶液(pH<7)中:c(OH-)+2c(C2O42-)=c(H+)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.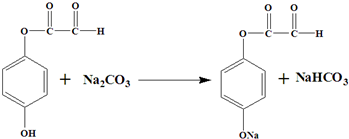 或
或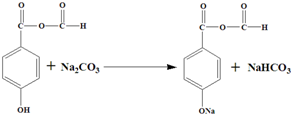 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸除钢铁表面的铁锈利用了硫酸的酸性 | |
| B. | 干冰用于人工降雨,是利用了干冰升华吸热 | |
| C. | 胃药中含氢氧化镁是因为氢氧化镁能给人提供镁元素 | |
| D. | 碳酸氢钠作焙制糕点的发酵粉是利用了碳酸氢钠能与发醇面团中的酸性物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA | |
| B. | 标准状况下,11.2L乙醇蒸气含共价键数目为4NA | |
| C. | 1molK与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA | |
| D. | 1L0.2mol•L-1NH4ClO4溶液中含NH4+数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com