
| A. | m=2 | |
| B. | 第二次平衡时,Z的浓度为0.2mol•L-1 | |
| C. | 两次平衡的平衡常数相同 | |
| D. | 又加入1molZ,平衡没有发生移动 |
分析 A.在此平衡体系中加入1molZ(g),则可等效为两等效平衡体系合,在合并瞬间X、Y、Z的体积分数不变,但单位体积内体系分子总数增多,依据勒夏特列原理平衡应朝使单位体积内分子总数减小方向移动,但再次达到平衡后,X、Y、Z的体积分数不变,则说明m+1=3;
B.根据平衡时Z的体积分数计算出Z的物质的量,然后根据c=$\frac{n}{V}$计算出Z的浓度;
C.平衡常数不受浓度的影响,温度不变,平衡常数不变;
D.加入Z后平衡向着逆向移动.
解答 解:A.某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)?3Z(g),平衡时X、Y、Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),则可等效为两等效平衡体系合,在合并瞬间X、Y、Z的体积分数不变,但单位体积内体系分子总数增多,依据勒夏特列原理平衡应朝使单位体积内分子总数减小方向移动,但再次达到平衡后,X、Y、Z的体积分数不变,则说明m+1=3,故m=2,故A正确;
B.m=2,则该反应为反应前后气体总量不变的反应,故第二次平衡时Z的物质的量为:4×10%=0.4mol,故Z的浓度为:$\frac{0.4mol}{2L}$=0.2mol/L,故B正确;
C.同一化学反应的平衡常数只与温度有关,两次平衡温度不变,故两次平衡的平衡常数相同,故C正确;
D.又加入1molZ,平衡发生移动,向着逆向移动,之至达到新的平衡,故D错误;
故选D.
点评 本题考查了化学平衡的影响因素,题目难度中等,根据题干数据正确判断m的值为解答关键,注意掌握影响化学平衡的因素,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ;取代反应
;取代反应 ;加成反应
;加成反应 ;取代反应
;取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Q1+Q2<Q3,则反应为放热反应 | B. | 若Q1+Q2>Q3,则反应为放热反应 | ||
| C. | 若E1+E2>E3,则反应为吸热反应 | D. | 若E1+E2>E3,则Q1+Q2>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度升高,c(HCO3-)减小 | |
| B. | 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变小 | |
| C. | 溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| D. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液pH的大小顺序是②>① | |
| B. | 若将两种溶液稀释相同倍数,pH变化较大的是② | |
| C. | 若分别加入25mL0.1mol•L-1盐酸后,pH较大的是① | |
| D. | 若两种溶液的pH均为9,则物质的量浓度大小关系是①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜有毒 | B. | 硫酸铜溶液是蓝色的胶体 | ||
| C. | 硫酸铜为电解质 | D. | 解毒的原因是Cu2+转化为沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
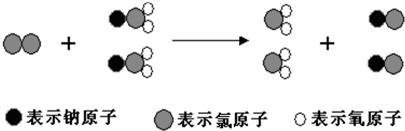
| A. | 该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl | |
| B. | 该反应是应是复分解反应 | |
| C. | 反应中Cl2既是氧化剂,又是还原剂 | |
| D. | NaClO2和ClO2中Cl元素的化合价相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com