
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.| 分子 | H2O | H2S |
| 中心原子杂化方式 | sp3 | |
| 键角 | 104.5° | 92.1° |
| 键长 | 95.7pm | 133.6pm |


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 次 数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 20.0 | 20.0 | 20.0 | 20.0 |
| 烧杯及所盛物质总质量/g | 169.8 | 189.6 | 209.5 | 229.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某稀硫酸和硝酸的混合溶液200mL,分成两份.向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO).向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示.
某稀硫酸和硝酸的混合溶液200mL,分成两份.向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO).向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)人们在对烷烃分子空间结构的研究中发现某一系列的烷烃分子只有一种一卤代物.如:
(1)人们在对烷烃分子空间结构的研究中发现某一系列的烷烃分子只有一种一卤代物.如:查看答案和解析>>
科目:高中化学 来源: 题型:
A、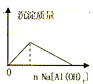 盐酸中加入Na[Al(OH)4]溶液 |
B、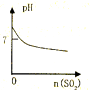 SO2气体通入溴水中 |
C、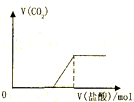 向Na2CO3溶液中逐滴滴加盐酸 |
D、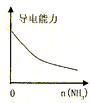 氨水通入醋酸溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com