
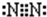 ;乙分子的结构式
;乙分子的结构式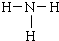 .
.分析 A、B、C、D、E均为短周期元素,它们的原子序数依次递增.A单质是自然界中密度最小的气体,则A为氢元素;C元素原子的最外层电子数是次外层的3倍,则C原子有2个电子层,最外层电子数为6,则C为氧元素;D原子的最内层电子数和最外层电子数之和等于其次外层电子数,则D原子最外层电子数为8-2=6,则D为硫元素;E单质性质活泼,原子序数大于硫元素,则E为Cl元素;B和C可形成多种气态化合物,A、B、C三种元素可以形成离子化合物甲,甲是一种常见的化肥,则B为氮元素,甲为硝酸铵;甲可以和氢氧化钠反应放出无色刺激性气味气体乙,乙能使湿润的红色石蕊试纸变蓝,则乙为氨气,以此解答.
解答 解:A、B、C、D、E均为短周期元素,它们的原子序数依次递增.A单质是自然界中密度最小的气体,则A为氢元素;C元素原子的最外层电子数是次外层的3倍,则C原子有2个电子层,最外层电子数为6,则C为氧元素;D原子的最内层电子数和最外层电子数之和等于其次外层电子数,则D原子最外层电子数为8-2=6,则D为硫元素;E单质性质活泼,原子序数大于硫元素,则E为Cl元素;B和C可形成多种气态化合物,A、B、C三种元素可以形成离子化合物甲,甲是一种常见的化肥,则B为氮元素,甲为硝酸铵;甲可以和氢氧化钠反应放出无色刺激性气味气体乙,乙能使湿润的红色石蕊试纸变蓝,则乙为氨气,
(1)C为氧元素,氧原子有2个电子层,最外层电子数为6,处于周期表中第二周期ⅥA族,
故答案为:第二周期ⅥA族;
(2)B为氮元素,氮气分子中氮原子之间形成3对共用电子对,氮气分子的电子式为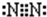 ,乙为氨气分子,分子中氮原子与氢原子之间形成1对共用电子对,氨气分子的结构式为
,乙为氨气分子,分子中氮原子与氢原子之间形成1对共用电子对,氨气分子的结构式为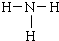 ,
,
故答案为: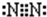 ;
;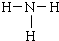 ;
;
(3)甲是硝酸铵,甲晶体中含有的化学键类型有:离子键、共价键,
故答案为:离子键、共价键;
(4)同周期自左而右非金属性增强,故非金属性Cl>S,氯化氢比硫化氢稳定、高氯酸酸性比硫酸强等证明这一结论,
故答案为:Cl;氯化氢比硫化氢稳定;高氯酸酸性比硫酸强;
(5)往硝酸铵的浓溶液中加入NaOH的浓溶液并加热,反应产生硝酸钠、氨气与水,反应的离子方程式是:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
点评 本题考查结构性质位置关系、物质推断、常用化学用语等,难度不大,推断元素是解题的关键,注意对基础知识的理解掌握.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 钚是f 区元素 | B. | 核外电子数238 | C. | 核内中子数 144 | D. | 钚是锕系元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
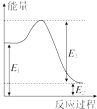 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
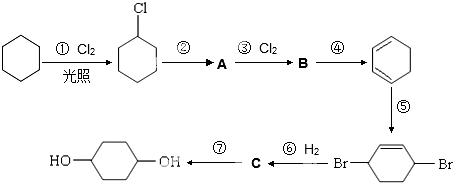
 ;
;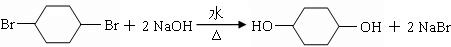 .
.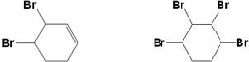 .
.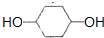 +O2$→_{△}^{催化剂}$
+O2$→_{△}^{催化剂}$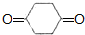 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径大小为:B>A>C | B. | 核电荷数:D>C>B>A | ||
| C. | A与D形成的化合物均是离子键 | D. | 生成的氢化物的稳定性为:D>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 氮气 (N2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
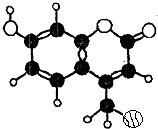 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )| A. | ①②③ | B. | ③④⑤ | C. | ②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
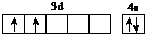
| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第4纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
 .
.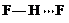 、
、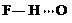 、
、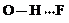 、
、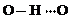 任意一种.
任意一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com