
分析 二氧化碳分子中含有1个C原子、2个O原子,据此计算出2mol二氧化碳分子中含有C、O原子的物质的量;然后根据m=nM、V=nVm分别计算出二氧化碳的质量及在标准状况下的体积.
解答 解:2molCO2含有2molC原子,含有O原子的物质的量为:2mol×2=4mol;该二氧化碳的质量为:44g/mol×2mol=88g;标准状况下2mol二氧化碳的体积为:22.4L/mol×2mol=44.8L,
故答案为:2;4;88;44.8.
点评 本题考查了物质的量的计算,难度不大,把握物质的量与摩尔质量、气体摩尔体积之间的关系为解答关键,试题侧重基础知识的考查,有利于培养学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | HNO3 | C. | CH3CH2OH | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24b L | B. | $\frac{c-a}{71}$×22.4L | C. | $\frac{c-a}{17}$×22.4L | D. | $\frac{a-c}{35.5}$×22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 6.830 | 13.660 | 30.000 |
| 二氧化硫气体的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.800 | 1.600 | 3.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
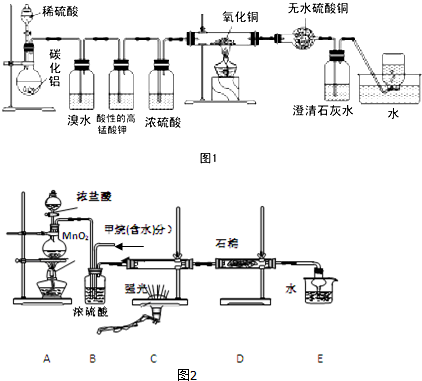
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
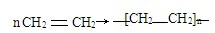 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com