
【题目】我国采用的Cu2O/TiO2–NaBiO3光催化氧化技术能深度净化工业含有机物的废水。回答下列问题:
(1)钛(Ti)的基态原子M能层中能量不同的电子有_____________种。
(2)该技术能有效将含有机物废水中的农药、醇、油等降解为水、二氧化碳、硝酸根离子等小分子。
①H2O、CH3OH、![]() 分子中O-H键的极性最强的是_____________。
分子中O-H键的极性最强的是_____________。
②C、N、O三种元素的电负性由大到小的顺序是_____________。
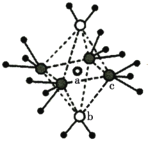
(3)将少量无水硫酸铜溶解在水中,形成蓝色溶液,再加入过量氨水,溶液变为深蓝色。深蓝色离子的结构如图所示,lmol该离子中所含σ键为_____________mol(包括配位键);向深蓝色溶液中缓慢加入乙醇,得到深蓝色晶体,加热该晶体先失去组分b的原因是_____________。
(4)铋合金具有凝固时不收缩的特性,用于铸造高精度铸型。金属铋的结构示意图如图1所示,其晶胞结构如图2所示。若铋原子的半径为rpm,则该晶体的密度为_____________gcm-3 (用含r和NA数学表达式表示)。

【答案】3 ![]() O>N>C 22 NH3与Cu2+的配位能力比H2O强
O>N>C 22 NH3与Cu2+的配位能力比H2O强 ![]() ×1030
×1030
【解析】
(1)钛(Ti)的基态原子核外电子排布为1s22s22p63s23p63d24s2,据此分析解答;
(2)①电离难易程度与极性关系,一般极性越大,越容易电离;
②同周期元素,随核电荷数增大,电负性逐渐增强;
(3)单键和配位键都为σ键,根据图示分析判断;乙醇为极性溶剂,NH3与Cu2+的配位能力比H2O强,将H2O夺走,晶体的极性降低;
(4)根据晶胞密度计算公式ρ=![]() =
=![]() 计算。
计算。
(1)钛(Ti)的基态原子核外电子排布为1s22s22p63s23p63d24s2,M能层即为Ti核外第三层,M层中有3个能级,每个能级上的电子能量不同,则能量不同的电子有3种;
(2)①H2O、CH3OH、![]() 都是极性分子,根据钠与水和醇的反应剧烈程度可知,水中的氢活性较大更易电离,电离难易程度与极性关系,一般极性越大,越容易电离,则H2O中O-H键的极性大于CH3OH中O-H键的极性,水是中性的,苯酚具有酸性,说明苯酚中羟基上的H比水更易电离,则上述分子中O-H键的极性最强的是
都是极性分子,根据钠与水和醇的反应剧烈程度可知,水中的氢活性较大更易电离,电离难易程度与极性关系,一般极性越大,越容易电离,则H2O中O-H键的极性大于CH3OH中O-H键的极性,水是中性的,苯酚具有酸性,说明苯酚中羟基上的H比水更易电离,则上述分子中O-H键的极性最强的是![]() ;
;
②C、N、O位于同周期,同周期元素,随核电荷数增大,电负性逐渐增强,三种元素的电负性由大到小的顺序是O>N>C;
(3)配位键和单键都是σ键,根据图示,a为铜离子,b为NH3,c为H2O,铜离子与NH3、H2O形成6个配位键,每个NH3中含有3个σ键,每个H2O中含有两个σ键,则lmol该离子中所含σ键为1mol×(6+3×4+2×2)=22mol;根据相似相溶,乙醇为极性溶剂,H2O为极性分子,NH3与Cu2+的配位能力比H2O强,乙醇将H2O夺走,降低蓝色晶体的极性,则蓝色晶体的溶解度降低而析出;
(4)根据图2所示,金属铋原子位于六棱柱的顶点,面心和体心,该晶胞中铋原子的个数为2×![]() +3+
+3+![]() ×12=6个,根据图1所示,若铋原子的半径为rpm,则晶胞面的边长为2rpm,上下面的距离h=
×12=6个,根据图1所示,若铋原子的半径为rpm,则晶胞面的边长为2rpm,上下面的距离h=![]() rpm,将六棱柱看做6个三棱柱构成,每个三棱柱的体积为
rpm,将六棱柱看做6个三棱柱构成,每个三棱柱的体积为![]() ×2rpm×
×2rpm×![]() rpm×
rpm×![]() rpm=4
rpm=4![]() r3pm3=4
r3pm3=4![]() ×10-30r3cm3,则晶胞的体积为6×4
×10-30r3cm3,则晶胞的体积为6×4![]() ×10-30r3cm3=24
×10-30r3cm3=24![]() ×10-30r3cm3,则该晶胞的密度为ρ=
×10-30r3cm3,则该晶胞的密度为ρ=![]() =
=![]() =
=![]() =
= ![]() ×1030gcm-3。
×1030gcm-3。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 将 | 生成了 |
B | 向浓度均为 |
|
C | 淀粉 | 还原性: |
D | 用pH试纸测得: |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“稀土之父”徐光宪对稀土萃取分离做出了巨大贡献。稀土是隐形战机、超导、核工业等高精尖领域必备的原料。钪(Sc)是稀土金属之一,如图是制备Sc的工艺流程。

已知:xNH4ClyScF3zH2O是ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。“脱水除铵”是复盐沉淀的热分解过程。
据此回答:
(1)在空气中焙烧Sc2(C2O4)3只生成一种碳氧化物的化学方程式为 ________。
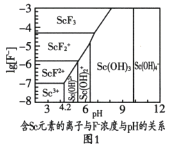
(2)图1是含Sc元素的离子与F-浓度和pH的关系。用氨调节溶液pH,调节3.5<pH<4.2原因是________。
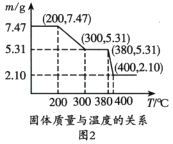
(3)图2是“脱水除铵”过程中固体质量与温度的关系,其中在380℃到400℃会有白烟冒出,保温至无烟气产生,即得到ScF3,由图像中数据计算复盐中x:z=________;工艺流程中可回收利用的物质是________。
(4)传统制备ScF3的方法是先得到ScF36H2O沉淀,再高温脱水得ScF3,但通常含有ScOF杂质,原因是________(用化学方程式表示)。流程中将复盐沉淀后“脱水除铵”制得纯度很高的SeF3,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬(Cr)常用于制造不锈钢和仪器仪表的金属表面镀铬。由FeCr2O4(亚铬酸亚铁)制备Cr的流程如下(+6价铬元素在酸性条件下以Cr2O72-的形式存在)。下列说法错误的是
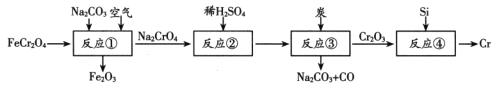
A.FeCr2O4中Cr元素的化合价为+3价
B.反应①中参加反应的FeCr2O4和Na2CO3的物质的量之比为3:1
C.反应③的化学方程式为Na2Cr2O7+2C![]() Cr2O3+Na2CO3+CO↑
Cr2O3+Na2CO3+CO↑
D.反应④中的Si可用Al来代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
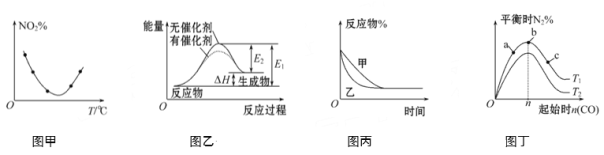
A. 图甲表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
B. 图乙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
C. 图丙表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,则P乙>P甲
3C(g)+D(g)的影响,则P乙>P甲
D. 图丁表示反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.lmol1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g)![]() CH2=CHCH=CH2(g)+H2(g)△H。
CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)已知化学键键能数据如下,由此计算△H=____________kJmo1-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJmol-1 | 348 | 612 | 412 | 436 |
(2)如图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度600℃。
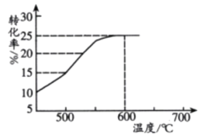
①请解释工业生产控制温度在600℃的原因___________。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=_________kPah-1;脱氢反应的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,p分=p总×物质的量分数)。
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol1,3-丁二烯,化学反应向_________(填“正反应”、“逆反应或“不移动”)方向进行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种重要的化工原料,常用作催化剂、杀菌剂。化学小组用如图装置(部分夹持装置略去)制备氯化亚铜。
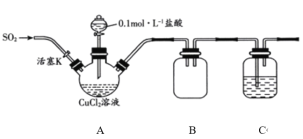
已知:①氯化亚铜是一种白色固体,能溶于氨水,微溶于水,不溶于酒精;在空气中会被迅速氧化。
②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
实验步骤:
I.打开分液漏斗活塞,向三颈瓶中加盐酸调pH至2~3。打开活塞K,通入SO2,溶液中产生白色沉淀,待反应完全后,再通一段时间的气体。
II.将反应混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)装置B的作用是________。
(2)步骤I中通入SO2发生反应的离子方程式是________。
(3)步骤II中采用抽滤法过滤的主要目的是________;用95%的乙醇代替蒸馏水洗涤的优点是________。
(4)化学小组同学在实验过程中,将分液漏斗中的0.lmolL-1盐酸换为6molL-1盐酸,通入SO2,最终未得到白色沉淀。
①对此现象有如下猜想:
猜想一:Cl-浓度过大,与CuCl发生反应
小组同学对猜想一的原理进行深入研究,查阅资料知:CuCl+Cl-CuCl2-,据此设计实验:将上述未得到沉淀的溶液_____(填操作),若观察到有白色沉淀析出,证明猜想一正确。
②猜想二:________。
设计验证猜想二是否成立的实验方案________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中可能含有Na2O、CaO、CuO、Fe2O3和SiO2中的若干种,为确定其成分,现取X进行如下实验(所加试剂均过量),下列说法正确的是
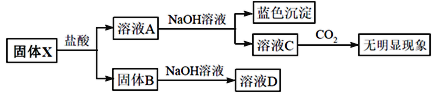
A.该混合物一定含有CuO、SiO2B.该混合物可能含有Na2O和Fe2O3
C.该混合物一定不含CaO和Na2OD.无法确定是否含有CaO和Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复旦大学的王永刚教授研究团队在柔性电池研究方面取得了新突破,发展了一种基于有机物电极材料的柔性水系锌电池。充放电过程中实现了芘四酮(PTO)与PTO-Zn2+的相互转化,原理如图所示。下列说法正确的是
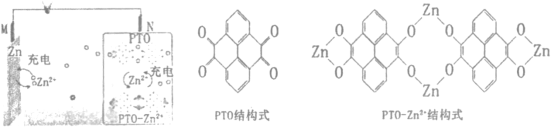
A.放电吋,N电极发生氧化反应
B.放电时,N极的电极反应式为PTO-Zn2+-8e-=2PTO+4Zn2+
C.充电时,M电极与电源负极相连
D.充电时,Zn2+向N极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com